RAS突變可以說是最難搞定的致癌突變之一了,發現最早,分佈最廣,雖說有了靶向藥,但也只對攜帶RAS突變的肺癌有較好的效果。幾乎全部攜帶KRAS突變的胰導管腺癌,也成為了當之無愧的癌中之王。
除了自己沒法被搞定,RAS突變還會賦予癌細胞一個外掛——大胞飲。這個大胞飲,原本是巨噬細胞用來吃掉那些入侵的病原體的技能,但卻被癌細胞用來吃掉周圍的蛋白質,為自己提供營養,增強適應性。
近日,紐約大學的Craig Ramirez和Dafna Bar-Sagi破解了RAS突變激活大胞飲的機制,從中或許可以找到破解這一外掛的方法。他們發現,RAS突變通過讓一種質子泵V-ATPase定位到質膜上,來激活大胞飲。這其中還涉及了兩種我們非常熟悉的物質—— 膽固醇和小蘇打。這一研究發表在Nature上[1]。
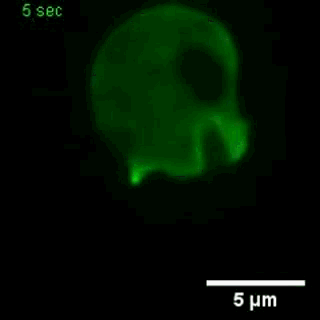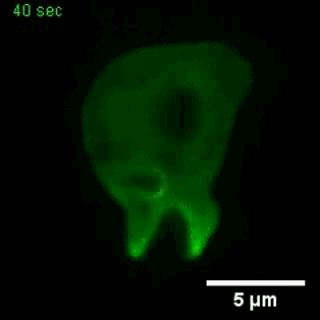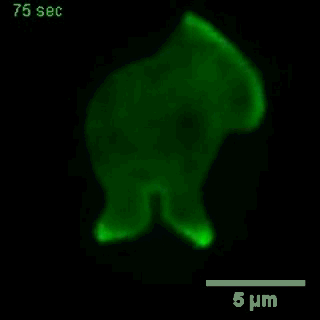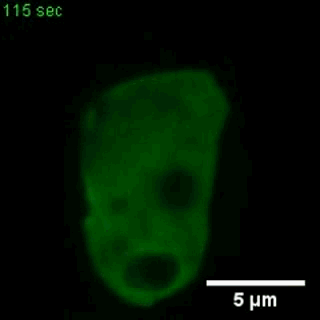
巨胞飲
(來自gfycat.com)
癌細胞,長得快,當然也能吃,但腫瘤裡能給癌細胞吃的卻不多,畢竟長得太快,血管跟不上,每人給送飯。
這就到了RAS突變大顯身手的時候了。在2013年,Dafna Bar-Sagi等人就發現,致癌的RAS突變可以刺激細胞進行大胞飲,將細胞外的蛋白質大口大口地吞下,水解消化成谷氨酰胺等癌細胞需要的營養物質。而抑制大胞飲可以減緩RAS驅動的腫瘤生長[2]。
不過這個RAS突變又是怎麼把大胞飲這個外掛給癌細胞的?研究人員利用siRNA,在攜帶HRAS突變的癌細胞中進行了篩選,發現了V-ATPase等四大類與大胞飲有關的基因。這其中,V-ATPase與大胞飲的關聯程度最高,也被發現與腫瘤生長轉移有關[3],研究人員決定就從它這入手研究。
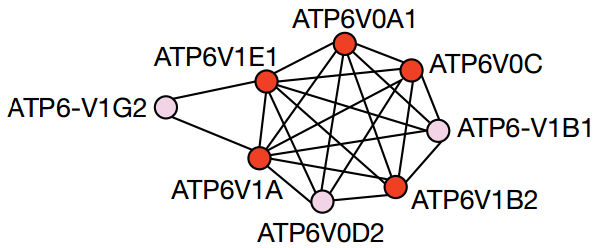
篩選中發現與大胞飲有關的V-ATPase基因
V-ATPase是細胞膜以及各種膜結構細胞器上的一種質子泵,負責向細胞外或者細胞器內輸送氫離子,有很重要的生理作用,參與了一系列物質的膜轉運和細胞內轉運過程[ 3]。比如把膽固醇從內體轉運到細胞膜上,就需要V-ATPase往內體裡泵入氫離子 [4]。
而細胞膜上的膽固醇,正是癌細胞大胞飲所必需的。調節大胞飲的一個重要因子——RAC1,正是靠著膽固醇,才到細胞膜上就位,發揮作用的[5]。
研究人員發現,缺失V-ATPase會讓細胞膜上的膽固醇流失,RAC1本身的活性雖還正常,但卻沒法定位到細胞膜上發揮功能,大胞飲自然也被抑制了。而外源性補充膽固醇,或者給RAC1換上一段不依賴膽固醇的膜定位序列,則都能恢復V-ATPase缺陷細胞的大胞飲功能。

膽固醇除了是心血管疾病的危險因素外,也是細胞膜必不可少的組分之一
(來自pixabay.com)
而在V-ATPase上游,突變的RAS對V-ATPase的調控,也是影響的V-ATPase的膜定位。研究人員發現,在RAS基因為野生型的細胞中,V-ATPase主要存在於胞質中,而致癌的HRAS突變或者KRAS突變,都會讓V-ATPase聚集到質膜上。而在肺癌、結腸癌、胰腺癌細胞中敲除KRAS,都會導致膜相關的V-ATPase減少。
在正常細胞中,比如腎臟中泌酸的閏細胞裡,V-ATPase的膜定位要靠一種碳酸氫鹽依賴的可溶性腺苷環化酶(sAC)。細胞外的碳酸氫鹽,也就是廚房裡常有的小蘇打,可以激活sAC引起細胞內cAMP水平的升高,進而通過激活蛋白激酶A(PKA),引起V-ATPase向質膜轉移。
研究人員發現,在攜帶RAS突變的癌細胞中,sAC和PKA的作用對於V-ATPase的膜定位也是必須的。使用sAC抑製劑或PKA抑製劑,都可以阻止V-ATPase的膜定位,進而抑制大胞飲。
而少了小蘇打的作用,比如去除培養基中的碳酸氫鈉,或者抑制碳酸氫鹽轉運蛋白,都能抑制RAS突變的癌細胞的大胞飲。一些碳酸氫鹽轉運蛋白也被發現與部分癌症有關,比如SLC4A7就被發現在胰腺癌和乳腺癌中上調,而且其上調與突變的RAS基因有關,能被PI3K和MEK抑製劑阻止。
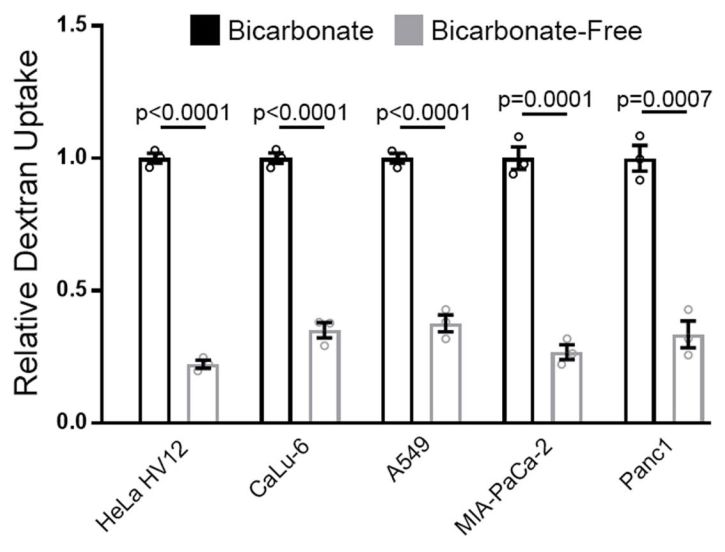
多種RAS突變的癌細胞,在無碳酸氫鹽的培養基中,大胞飲都受到了抑制
也就是說,RAS突變可能通過上調碳酸氫鹽轉運蛋白SLC4A7,激活了sAC-PKA軸,進而引起V-ATPase、膽固醇和RAC1依次定位到細胞膜上,這才有了大胞飲這個外掛。這之中,讓小蘇打進入細胞的SLC4A7,和把膽固醇轉移到細胞膜的V-ATPase,都可能成為很好的抗癌靶點,畢竟它們位於細胞表面,藥物可以很容易的接觸到它們。
不過需要注意的是,缺乏RAS突變的癌細胞中,單靠激活PKA並不能引起大胞飲。在RAS突變和大胞飲之間,可能還有更多的機制和治療靶點有待我們探索。
編輯神叨叨
參考文獻:
1. RAMIREZ C, HAUSER AD, VUCIC EA, et al. Plasma membrane V-ATPase controls oncogenic RAS-induced macropinocytosis[J]. Nature, 2019.
2. Commisso C, Davidson SM, Soydaner-Azeloglu RG, et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells[J]. Nature, 2013, 497(7451): 633.

