在科學領域有個概念,叫做範式。範式指的是科學體系的基本模式、結構和功能,是一組公認的假設、理論、方法和標準的總和。可以說,範式就是公認的科學的框架。
而隨著新技術的不斷出現,科學範式也在逐漸轉變。
舉個簡單的例子,外科手術終結了乳腺癌無法治癒的歷史,影像學技術使我們前所未有地看清腫瘤,化學治療和放射治療進一步提高了患者的治愈率,而靶向治療史上劃時代的突破— 抗HER2靶向藥讓原本惡性程度最高的HER2陽性乳腺癌治療變得可以被馴服。
可以說,是科學技術的一步步積累,才最終奠定了循證醫學的治療選擇,包括我們今天要談到的HER2陽性早期乳腺癌新輔助治療-手術-術後輔助治療的系統治療。
如今掀起HER2陽性早期乳腺癌治療新一輪範式轉移革命的,不用多說,熟悉的讀者都會立刻想到曲妥珠單抗(H)+帕妥珠單抗(P)的抗HER2雙靶向治療(以下簡稱PH雙靶)。
今天我們就來聊聊PH雙靶治療在乳腺癌系統治療中的關鍵節點。由於一篇文章能承載的內容有限,我們把目光集中在HER2陽性早期乳腺癌中/高危(中/高複發/轉移風險)患者這一群體,也就是腫瘤大於2cm或淋巴結陽性的HER2陽性早期乳腺癌(即臨床II期和III期)患者。
不打無準備之仗
如果要給新輔助治療冠上一個形容比喻,那麼我想到的就是“不打無準備之仗”。
新輔助治療的意義不僅僅體現在單純的治療上,它能夠在術前縮小腫瘤、降低手術難度和並發症風險、增加保乳手術的可能性,甚至為原本無法手術的患者提供治療機會。
除了增加腫瘤的可控性和早期乳腺癌的治愈可能之外,從另一個角度來看,新輔助治療其實更是一次難得的快速評估藥物治療效果和篩選目標人群的好機會[1]。
既然是一種治療方法,那麼必然要有評估其療效優劣的標準。與臨床試驗中常見的PFS、OS等標準不同,衡量新輔助治療有著另外一把特殊的標尺—— 病理學完全緩解(Pathological complete response,pCR) [2],也就是新輔助治療後乳腺和淋巴結無殘留侵襲性病變(tpCR)、或乳腺無殘留侵襲性病變(bpCR),意味著侵襲性癌細胞被全部消滅,效果很好。
為了搞清楚pCR與長期臨床獲益的關係,FDA的CTNeoBC國際工作組對符合標準的臨床研究數據進行了綜合分析統計,最終納入了來自12項國際新輔助研究的超過11955名乳腺癌患者。
分析結果顯示,實現pCR的乳腺癌患者無事件生存率和總生存率有了大幅度的提高,尤其是HER2陽性患者,效果尤為顯著 [3]。
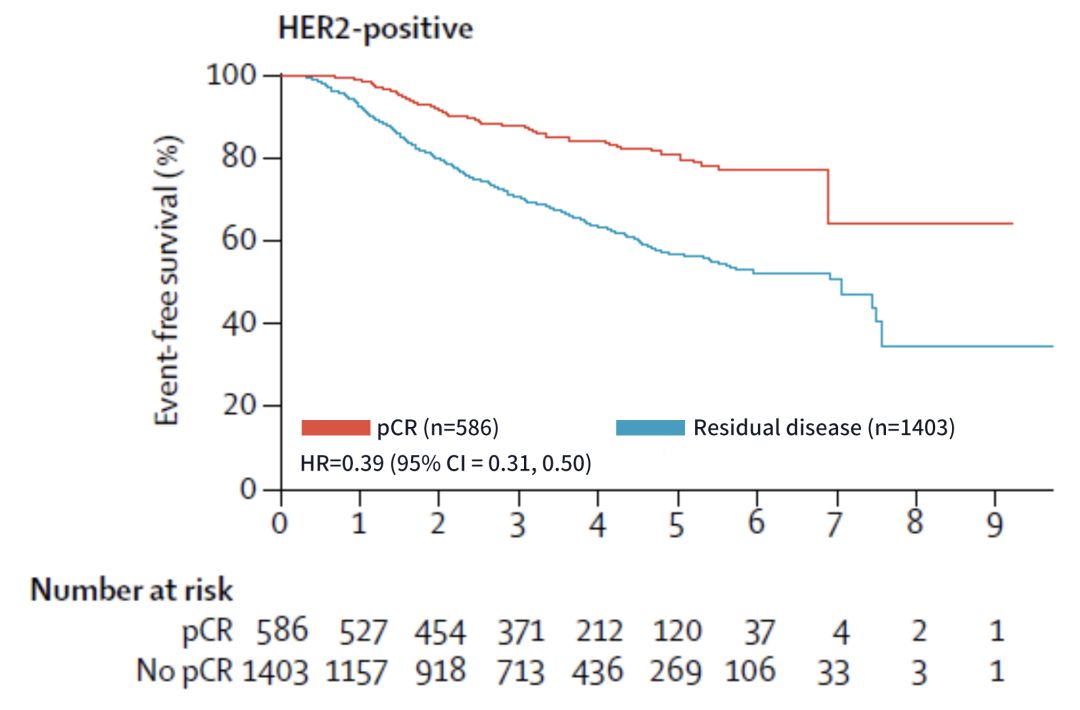
實現pCR的患者預後更好
由此可見,實現pCR對患者來說有重要的預後意義,選擇合適的新輔助治療方案也就成了系統治療的第一個關鍵節點。
沒有懸念的答案
對於高危的HER2陽性早期乳腺癌,新輔助用什麼治療方案?這個問題的答案幾乎毫無懸念,因為只要你翻開各大乳腺癌診療指南,就會發現它們都推薦化療聯合靶向治療,而靶向治療的選擇幾乎都推薦曲妥珠單抗與帕妥珠單抗的抗HER2雙靶治療。
PH雙靶新輔助的第一次亮相始於Ⅱ期臨床研究NeoSphere。2012年,NeoSphere的主要結果登上《柳葉刀·腫瘤學》[4],各組方案中,PH雙靶+多西他賽表現出了碾壓式的優勢,患者tpCR率達到39.3%,幾乎是H單靶+多西他賽數據(21.5%)的翻倍。
正是基於這一結果,FDA加速審批通過了PH雙靶+化療用於HER2陽性早期乳腺癌患者新輔助治療的適應症。
對中國患者來說,意義更大的則是另一項臨床試驗——PEONY。PEONY試驗由複旦大學附屬腫瘤醫院牽頭,是一項主要在中國患者人群中驗證PH雙靶新輔助療效的Ⅲ期研究。
不久之前,PEONY試驗數據公佈在了《JAMA腫瘤學》上[5],PH雙靶再次驗證了其驚人的潛力。比起曲妥珠單抗+多西他賽組患者21.8%的tpCR率,雙靶+多西他賽組達到了39.3%,又是近一倍的差距!
無懼人種差異,PH雙靶新輔助的獲益在中國患者群體中依舊成立。也是基於這一數據,PH雙靶+化療一舉拿下了國內的HER2陽性早期乳腺癌患者新輔助適應症。
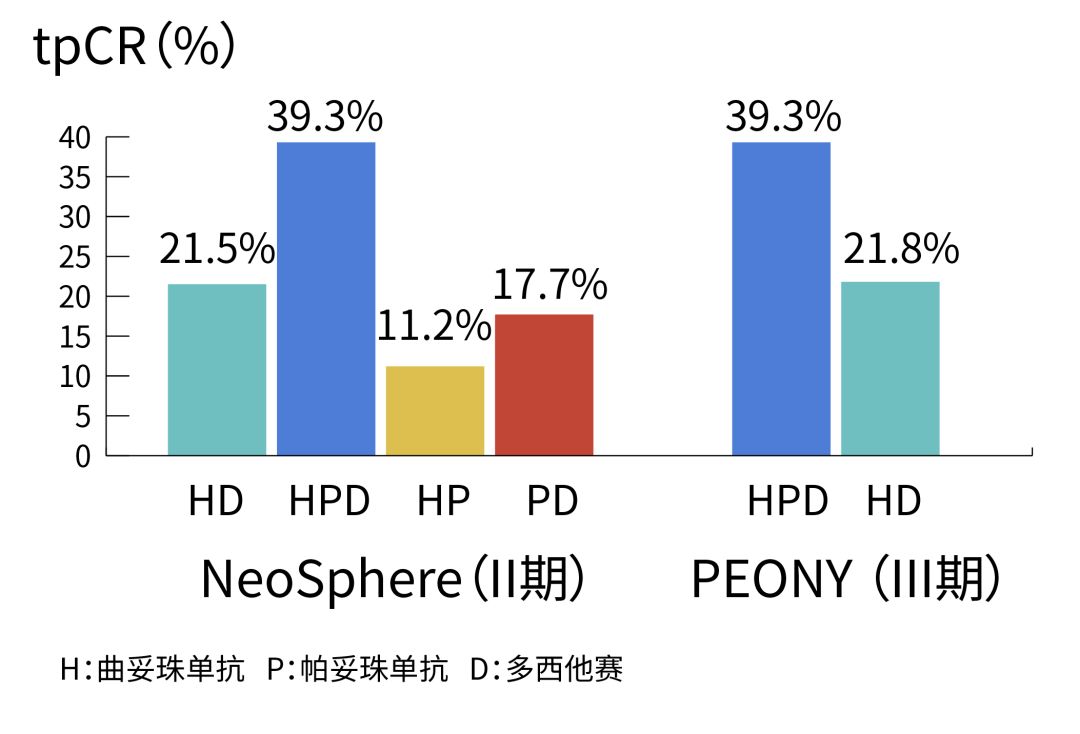
PH雙靶使患者的tpCR率提升近一倍
不過,鑑於復雜多變的臨床情況,TRYPHAENA、BERENICE和TRAIN-2三項研究在PH雙靶的情況下聯合其他化療藥物以及不同新輔助治療週期數方面也進行了探索,結果證明,PH雙靶依然打出了漂亮的配合戰,tpCR率達54.7-68% [6-8]。
pCR不是萬能的
談了pCR對預後的重要意義,又列舉了好幾個PH雙靶重磅研究的pCR數據,很容易讓人產生一種對pCR盲目追求的印象。這裡我得給諸位提個醒兒,pCR不是萬能的。
實現pCR是新輔助療效的體現、是患者預後更好的標識,但pCR絕不等於治療完成、從此可以高枕無憂。
如果我們把目光放寬一些,就會發現,靶向治療前時代HER2本身就是預後差的標誌。pCR不等於不復發,在新輔助後達到pCR的乳腺癌患者中,HER2陽性人群的複發風險是相對更高的 [9]。
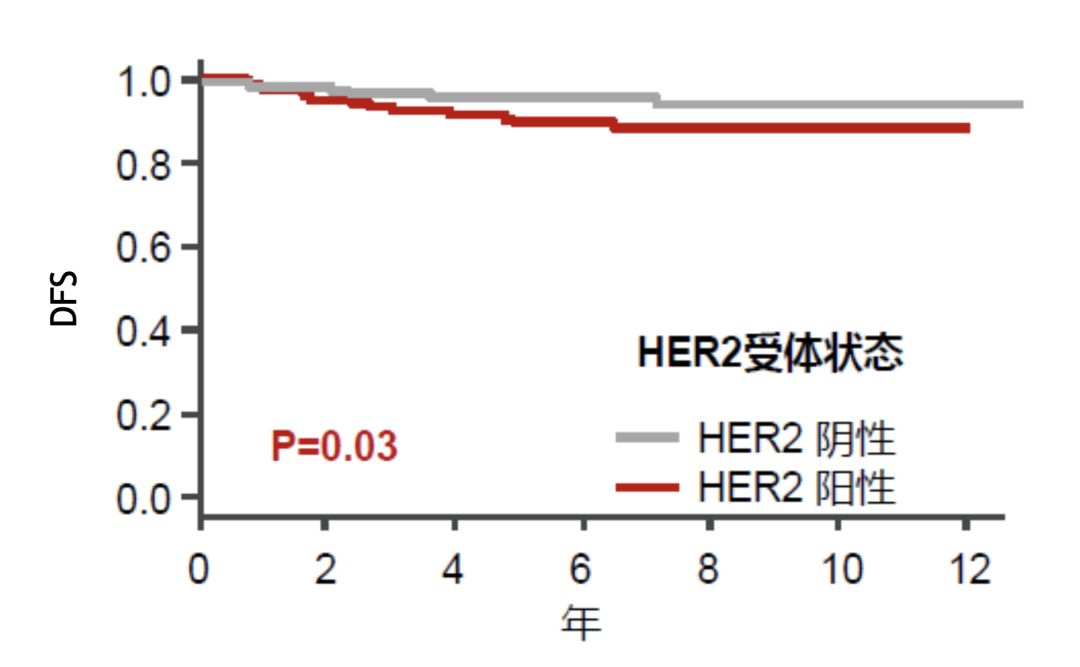
新輔助後達到pCR患者中HER2陽性人群復發風險更高
這裡我要回放這張圖片[3]。可以看到,在HER2陽性患者中,雖然達到pCR的患者預後更好,但仍存在較高的複發風險。
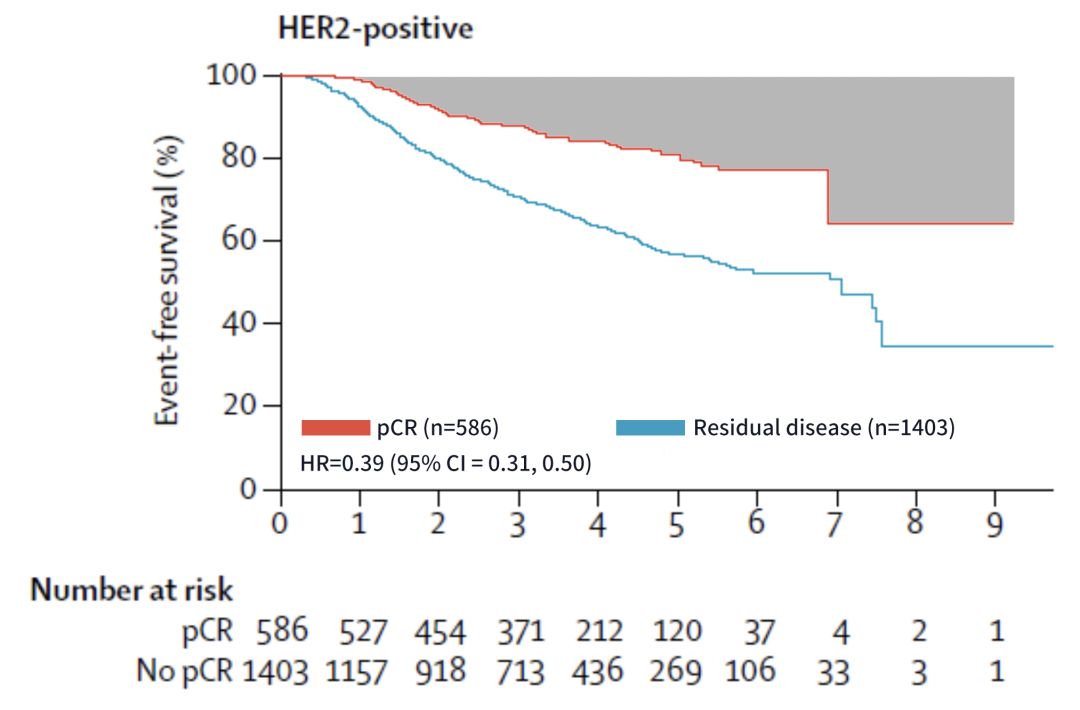
pCR患者仍有一定的複發風險
PH雙靶治療後pCR患者的複發風險有多大?從NeoSphere的數據來看約為12%[10],TRYPHAENA則為8.6%[11]。如何在後續的治療中把這部分數字進一步壓縮,這便是乳腺癌系統治療的第二個關鍵節點。
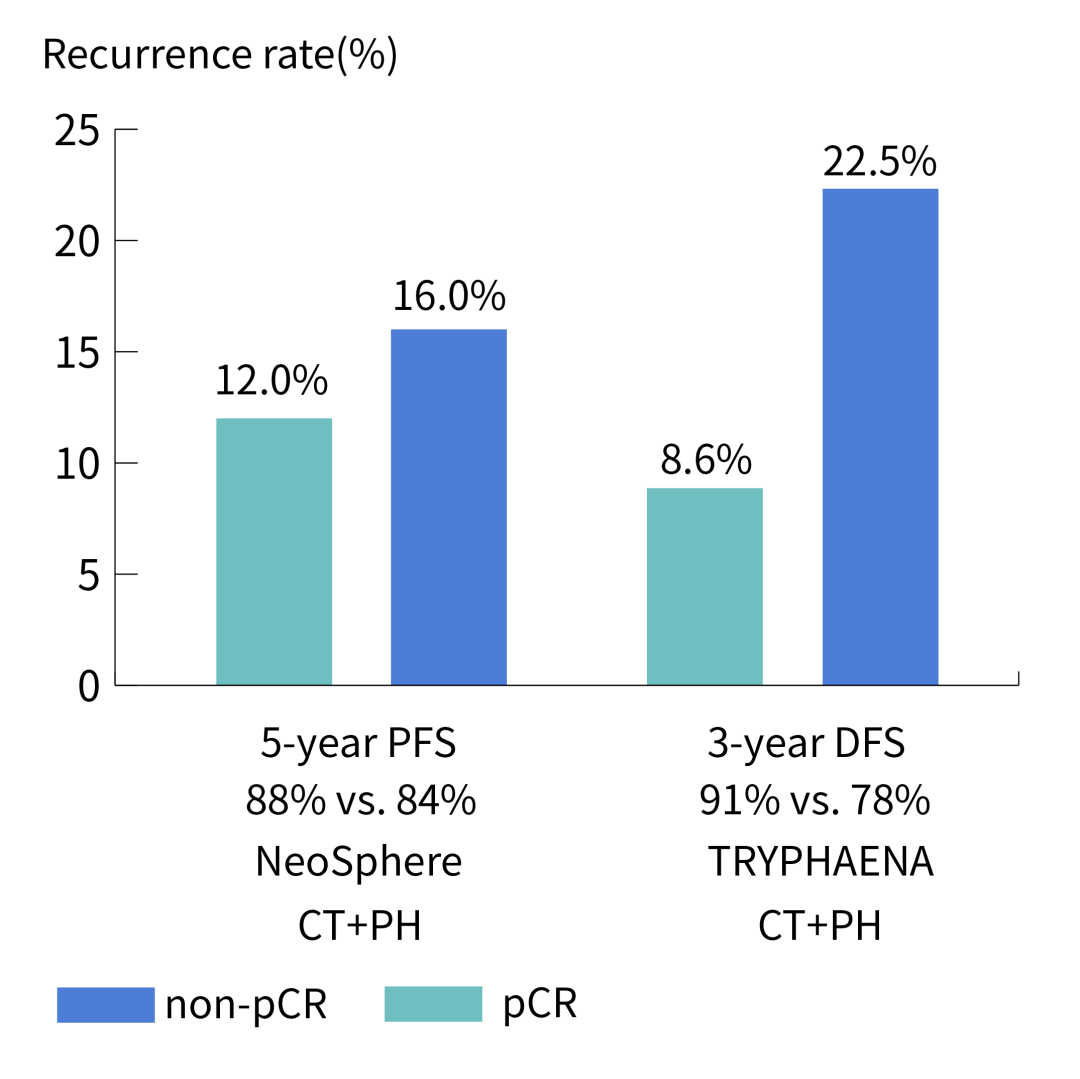
從NeoSphere和TRYPHAENA試驗來看,PH雙靶後pCR患者仍有一定的複發風險
既能先鋒,也能壓陣
從H單靶+化療到PH雙靶+化療,新輔助已經證明是成功的了,輔助治療是不是也可以復制這樣的療效優勢呢?
這就必須要來聊聊另一項Ⅲ期臨床研究APHINITY了。
2017年,APHINITY研究的3年結果發佈在《新英格蘭醫學雜誌》上,在4800餘名HER2陽性早期乳腺癌患者中,首次展現了PH雙靶+化療作為輔助治療的療效優勢[12]。
研究結果顯示,與曲妥珠單抗聯合化療相比,PH雙靶+化療可以將患者的複發/死亡風險(無侵襲性疾病生存,iDFS)降低19%,絕對獲益0.9%。特別亮眼的是,淋巴結陽性組患者iDFS風險降低23%,絕對獲益1.8%。
正是基於這一研究結果,PH雙靶相繼拿下了FDA及國內的HER2陽性早期高危乳腺癌輔助治療適應症。
日前,在2019 SABCS上,APHINITY帶來了6年隨訪結果,數據更加驚艷[13]。雙靶+化療組患者的6年iDFS達到90.6%,復發/死亡風險下降達到了23%,絕對獲益增加至2.8%。這無疑說明,雙靶+化療輔助治療能夠讓患者得到長期獲益,而且隨時間延長、獲益更加明顯。
並且,與3年結果一致,淋巴結陽性的患者獲益尤其顯著,復發/死亡風險降低27%,絕對獲益4.5%。
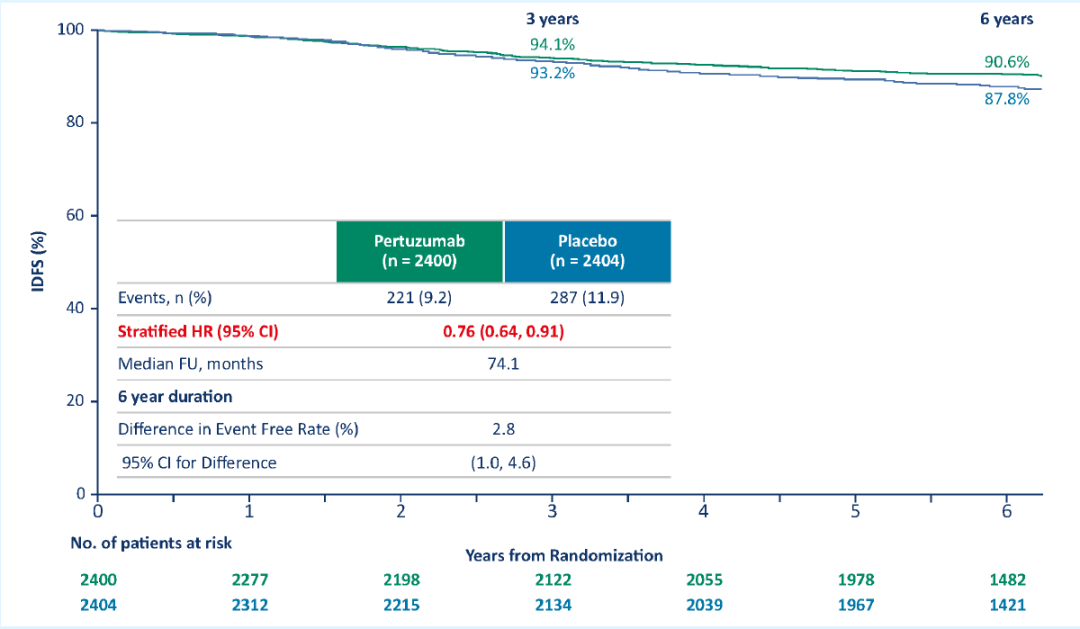
PH雙靶輔助治療給患者帶來長期獲益
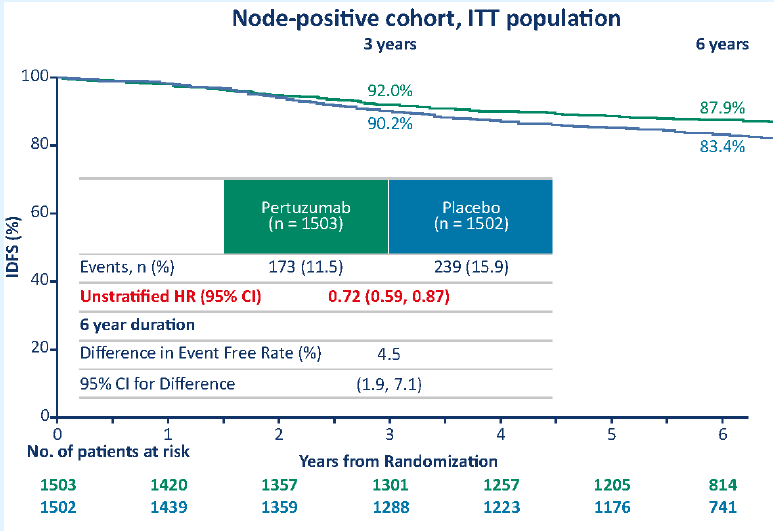
PH雙靶輔助治療在淋巴結陽性患者中獲益尤其顯著
此外,不同激素受體(HR)狀態患者的分析結果也很引人關注。
APHINITY 3年隨訪時僅有HR陰性患者表現出了較明顯的獲益,而在6年隨訪數據中,二者都實現了2.5%-3.0%的絕對獲益;可見無論HR狀態如何,都是能夠從雙靶+化療輔助治療中受益的。
NCCN 2019 V3指南提出,在新輔助治療後達到pCR的HER2陽性患者,應完成一年的抗HER2治療 [14]。
強強聯手……
無論新輔助治療還是輔助治療,PH雙靶都表現出了顯著的優勢,這不由得讓人暢想,PH雙靶新輔助+輔助全程使用是不是能夠進一步提升獲益呢?PH雙靶新輔助治療後達到pCR的患者是否應該繼續使用PH雙靶作為輔助治療方案呢?
遺憾的是,科學的腳步暫時還追不上期待,我們目前還沒有直接的證據來支持這份暢想。不過,PH雙靶新輔助+輔助到底行不行?下面這兩個研究的結果已經“初露端倪”。
今年6月召開的2019 ASCO大會上,KRISTINE研究公佈了3年的隨訪數據[15]。在這項研究中,有一組患者採取了PH雙靶+多西他賽+卡鉑新輔助治療6個週期,術後繼續PH雙靶治療12個週期的方案。
數據顯示,PH雙靶新輔助實現pCR的患者,術後繼續接受PH雙靶輔助治療的3年iDFS高達97.5%,可見PH雙靶新輔助+輔助的療效還是非常值得期待的。
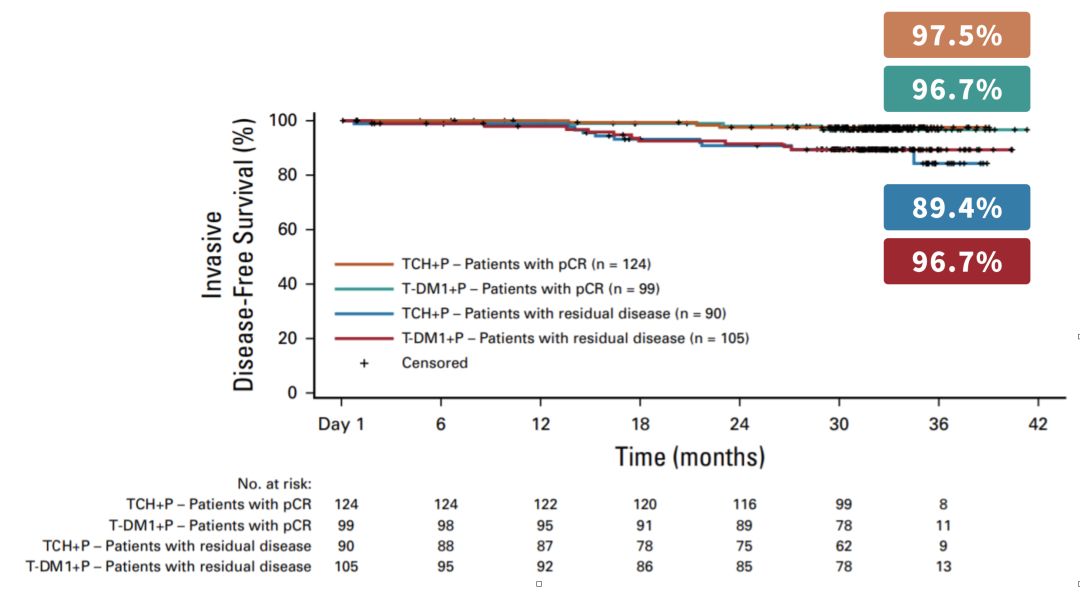
PH雙靶新輔助後pCR患者繼以PH雙靶輔助的3年iDFS達到97.5%
同時, PH雙靶新輔助+輔助的安全性也在BERENICE研究中得到了證實[16]。
2019年的SABCS上也有一項研究探討了這個問題[17]。這項匯總分析納入了5項HER2陽性早期乳腺癌的新輔助研究,患者按照不同的新輔助/輔助治療方案,可以分為三組:第一組在兩個階段都選擇H(曲妥珠單抗)單靶;第二組新輔助階段使用PH(曲妥珠單抗聯合帕妥珠單抗)雙靶,輔助治療使用H單靶;第三組在新輔助和輔助兩個階段都使用PH雙靶。
可以看到,對於那些新輔助治療後達到pCR的患者來說,相比H單靶新輔助+輔助,PH雙靶新輔助+H單靶輔助的校正危險因素後復發風險降低了41%,PH雙靶新輔助+輔助的複發風險則降低了47%。在PH雙靶新輔助+H單靶輔助的基礎上,PH雙靶新輔助+輔助仍表現出進一步降低風險的趨勢。
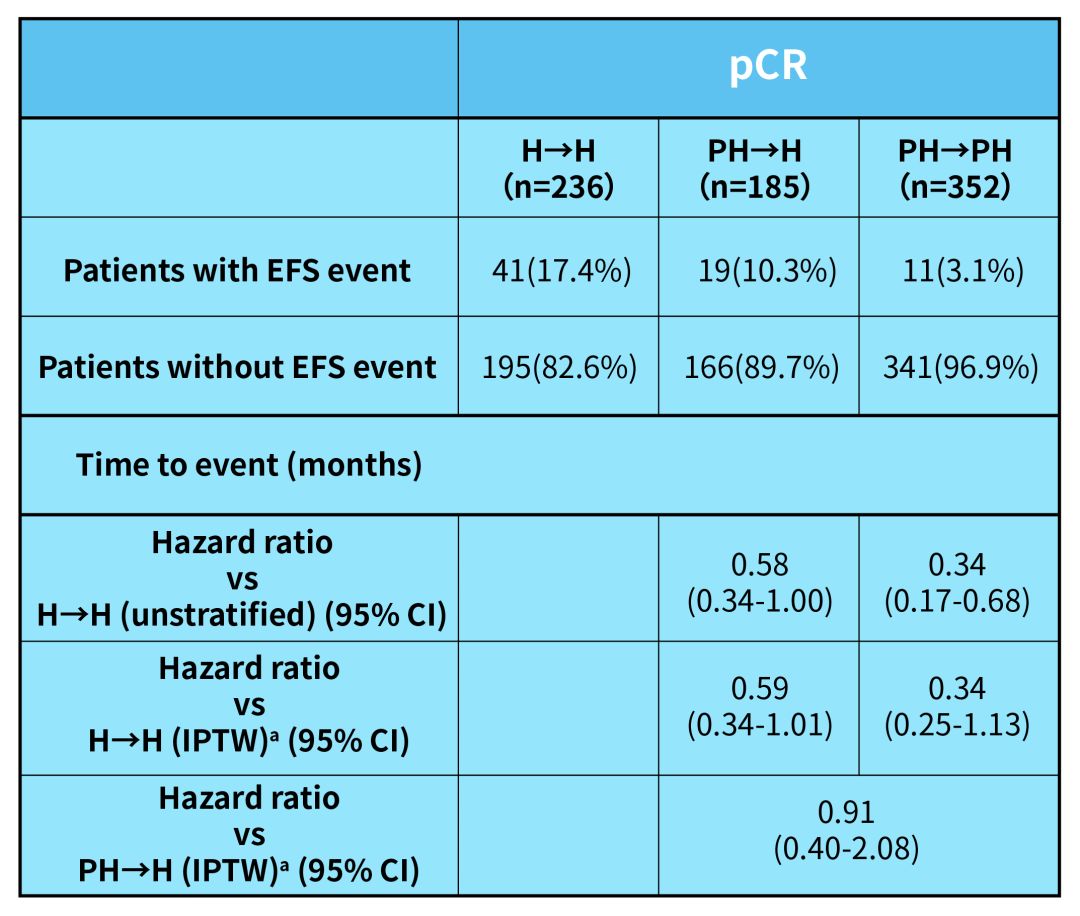
PH雙靶新輔助+輔助方案表現出預後進一步提升的趨勢
研究還分析了三組pCR患者的3年無事件生存(EFS)率:PH雙靶新輔助+輔助組EFS達到95%,比H單靶新輔助+輔助組高出8%,比PH雙靶新輔助+H單靶輔助組也高出3%。不過要說明的一點是,該薈萃分析中PH雙靶新輔助+輔助組的隨訪時間較短、同時Ⅱ期患者的比例也較高,因此可以說PH雙靶新輔助+輔助方案看起來確實很有潛力,但仍有待於時間和更多研究的考驗。
雙靶時代的來臨
對於HER2陽性早期乳腺癌高危患者,毫不誇張地說,我們現在正站在從單靶時代到雙靶時代的交點上。
在單靶時代,新輔助治療和輔助治療階段使用基於曲妥珠單抗的治療方案業已成為臨床上的標準選擇;而基於最新的臨床研究證據,曲妥珠單抗+帕妥珠單抗的雙靶方案已經交出更加優秀的成績。國際指南也相繼對PH雙靶在HER2陽性早期乳腺癌高危患者新輔助及輔助治療階段的表現予以認可並推薦。
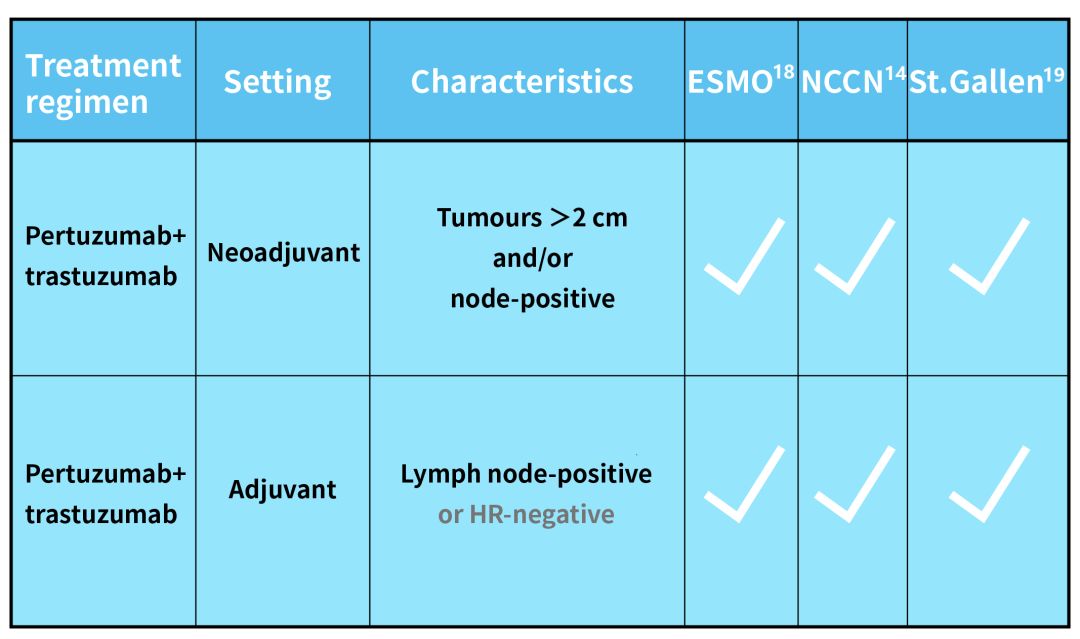
PH雙靶方案已經獲得國際各大指南認可及推薦
那麼現在HER2陽性早期高危乳腺癌系統治療的路徑應該是:基於循證醫學證據選擇PH雙靶聯合化療的新輔助治療以盡可能實現pCR;達到pCR的患者術後如繼續PH雙靶輔助治療,可能獲得更好的生存獲益。但如果新輔助治療未達到PCR,Katherine研究證實輔助治療使用T-DM1成為標準選擇[20]。
而對於中國患者來說更好的消息是,2019年11月帕妥珠單抗的輔助治療和新輔助治療適應症均已被納入了醫保目錄。相信將有更多的HER2陽性早期高危患者從PH雙靶治療獲益,從而得到更多治愈。
至於PH雙靶新輔助+輔助治療的生存獲益是否確實能夠1+1>2,不妨讓我們等待PEONY研究的長期隨訪數據。期待這項中國為主的研究能夠給我們更清晰的臨床指引。
[1]Prowell TM, Pazdur R. Pathological complete response and accelerated drug approval in early breast cancer. N Engl J Med 2012; 366: 2438–41.
[2]Bonadonna G, Valagussa P, Brambilla C, Ferrari L.Preoperative chemotherapy in operable breast cancer. Lancet 1993;341: 1485.
[3]Cortazar P, Zhang L, Untch M, et al. Pathological complete response and long-term clinical benefit in breast cancer: the CTNeoBC pooled analysis[J]. The Lancet, 2014, 384(9938): 164-172.
[4]Gianni L, Pienkowski T, Im YH, et al. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial[J]. The lancet oncology, 2012, 13(1): 25-32.
[5]Shao Z, Pang D, Yang H, et al. Efficacy, Safety, and Tolerability of Pertuzumab, Trastuzumab, and Docetaxel for Patients With Early or Locally Advanced ERBB2-Positive Breast Cancer in Asia: The PEONY Phase 3 Randomized Clinical Trial [J]. JAMA oncology, 2019.
[7]Swain SM, Ewer MS, Viale G, et al. Pertuzumab, trastuzumab, and standard anthracycline-and taxane-based chemotherapy for the neoadjuvant treatment of patients with HER2-positive localized breast cancer (BERENICE): a phase II, open -label, multicenter, multinational cardiac safety study[J]. Annals of Oncology, 2017, 29(3): 646-653.
[9]Asaoka M, et al. 2018 SABCS Abstract P1-15-12
[11]Schneeweiss A, Chia S, Hickish T, et al. Long-term efficacy analysis of the randomised, phase II TRYPHAENA cardiac safety study: Evaluating pertuzumab and trastuzumab plus standard neoadjuvant anthracycline-containing and anthracycline-free chemotherapy regimens in patients with HER2-positive early breast cancer[J]. European Journal of Cancer, 2018, 89: 27-35.
[12]von Minckwitz G, Procter M, de Azambuja E, et al. Adjuvant pertuzumab and trastuzumab in early HER2-positive breast cancer[J]. New England Journal of Medicine, 2017, 377(2): 122-131.
[13]M. Piccart, et al. A randomised multi-center, double-blind, placebo-controlled trial comparing chemotherapy plus trastuzumab plus pertuzumab versus chemotherapy plus trastuzumab plus placebo as adjuvant therapy in patients with operable HER2-positive early breast cancer[ C].San Antonio Breast Cancer Symposium,2019.
[14]NCCN Clinical Practice. Guidelines in Oncology (NCCN Guidelines) Breast Cancer Version 3. 2019
[15]Hurvitz SA, et al. Neoadjuvant trastuzumab (H), pertuzumab (P), and chemotherapy versus trastuzumab emtansine (TDM1) and P in human epidermal growth factor receptor 2 (HER2)- positive breast cancer (BC): Final outcome results from the phase III KRISTINE study. ASCO 2019 (Abstract 500; oral presentation)
[16]Dang C, Ewer MS, Delaloge S, et al. Abstract P5-20-04: Safety of adjuvant treatment with pertuzumab plus trastuzumab after neoadjuvant anthracycline-based chemotherapy in patients with HER2-positive localized breast cancer: Updated results from the BERENICE study[J]. 2018.
[17]Sandra M. Swain, et al.Risk of Recurrence And Death in Patients With Early HER2-positive Breast Cancer Who Achieve a Pathological Complete Response (pCR) After Different Types of HER2-targeted Therapy: A Retrospective Exploratory Analysis[C] .San Antonio Breast Cancer Symposium,2019.
[18]F Cardoso, S Kyriakides, S Ohno, F Penault-Llorca, P Poortmans, IT Rubio, S Zackrisson, E Senkus, on behalf of the ESMO Guidelines Committee, Early breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up, Annals of Oncology, Volume 30, Issue 8, August 2019, Pages 1194–1220, https://doi.org/10.1093/annonc/mdz173
[20]von Minckwitz G, Huang CS, Mano MS, et al. Trastuzumab emtansine for residual invasive HER2-positive breast cancer[J]. New England Journal of Medicine, 2019, 380(7): 617-628.