過去科學界一直認為,輔助T細胞就跟動畫裡一樣,是坐在辦公室不親自上火線的指揮官,不過在《自然》創刊150週年特刊上發表的最新研究成果,要把這個觀念顛覆一下啦。
聖路易斯華盛頓大學的研究團隊發現,需要識別MHC II類抗原才激活的CD4+T細胞,也就是輔助性T細胞的免疫應答,對CD8+效應T細胞的抗癌起著重要作用,兩種T細胞必須協同作戰,才能激活足夠強大的抗癌免疫殺傷 [1]!
用《自然》配發社論的話說,這很可能是提升免疫檢查點抑製劑療效的關鍵。
很長時間以來,科學家們對免疫治療和治療中免疫細胞的關注,都集中在了身處最前線的效應T細胞身上,畢竟它們是識別和殺傷癌細胞的主力嘛,而輔助T細胞的作用卻不夠明確,有人認為它們可有可無,甚至會“拖後腿”。
這一方面是因為效應T細胞可以直接殺傷癌細胞,另一方面則是因為癌細胞新抗原的特殊性。大多數能夠激活抗腫瘤免疫的癌細胞新抗原,從種類上來說屬於主要組織相容性複合體(MHC)I類限定分子[2],它們只能被效應T細胞識別。
而能被輔助性T細胞識別的MHC II類限定分子,在已知的新抗原中寥寥無幾,因此對輔助性T細胞的研究,也往往只是從過往已知的對效應T細胞的分化和增殖入手。它親自下場識別MHC II類新抗原,並不被認為是免疫治療起效的必要條件。
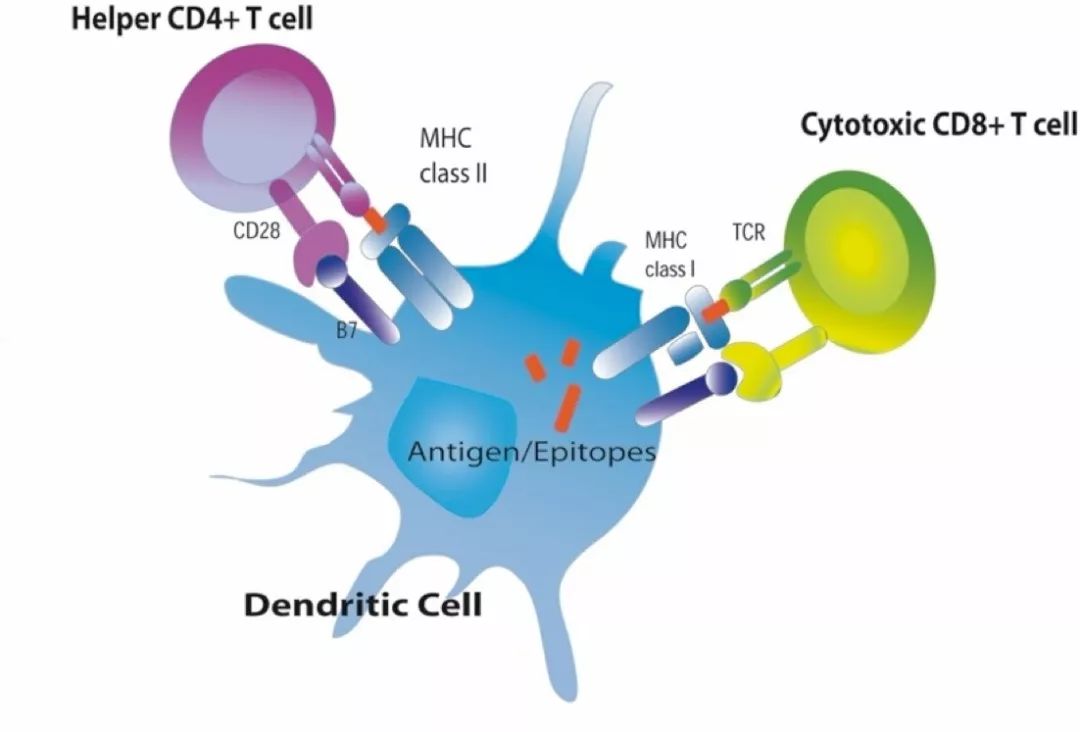
當然,識別抗原還少不了抗原提呈細胞(ADC)的參與
(圖片來源:波士頓大學)
但單靠效應T細胞激活的免疫應答,往往不足以消滅腫瘤,不然免疫檢查點抑製劑療法平均的客觀緩解率,就不會是30%[3]了。影響療效的原因有很多,但歸根結底都和免疫細胞有關,科研的焦點,就自然轉移到了曾經的“配角”身上。
2014年,《科學》上首次發表了利用靶向特定突變的CD4+T細胞療法,治療晚期癌症的報告[4],證實了輔助性T細胞免疫應答的存在。此後在2015和2017年,兩例採用腫瘤疫苗,激活輔助性T細胞抗癌的案例先後登上《自然》[5-6]。
然而奇點糕此前也提到過,MHC II類新抗原在癌細胞表面表達水平一般很低,和使用疫苗時的抗原數量根本沒得比,人體正常也不會有過繼性細胞療法那麼多的輔助性T細胞。
那麼在應對“正常”的癌細胞,進行免疫檢查點抑製劑治療時,輔助性T細胞識別MHC II類新抗原,激活的免疫效應,作用到底有多大呢?

別看效應T細胞把癌細胞圍住了,但有可能只是圍而不攻
(圖片來源:NIH)
這就是本次研究的團隊想要解開的謎題。首先,為了盡量排除已知抗原激活免疫應答的影響,研究團隊特地選擇了免疫原性很低,免疫檢查點抑製劑治療基本無效的一個惡性肉瘤細胞系,給這些癌細胞插上MHC I類和II類新抗原來展開實驗。
由於已被確認的MHC II類限定分子新抗原很少,研究團隊借助算法模擬預測的方式,才找到一種僅可以被輔助性T細胞識別的MHC II類新抗原,命名為mITGB1,對應的還有僅可以被效應T細胞識別的MHC I類新抗原(mLAMA4)。
把新抗原表達不同的肉瘤細胞,注射到小鼠體內時,單獨表達mITGB1或者mLAMA4的癌細胞,並不能誘導抗癌免疫應答,腫瘤該怎麼長怎麼長;但兩種新抗原同時表達時,腫瘤的生長速度卻變慢了,明顯是受到了免疫應答的殺傷!
使用PD-1抑製劑+CTLA-4單抗聯合治療時,腫瘤更是完全消失了。如果把mITGB1和mLAMA4,換成兩種只能被效應T細胞識別的MHC I類新抗原,免疫治療的療效就基本消失了。這說明激活免疫重要的是抗原類型,而不是抗原量。
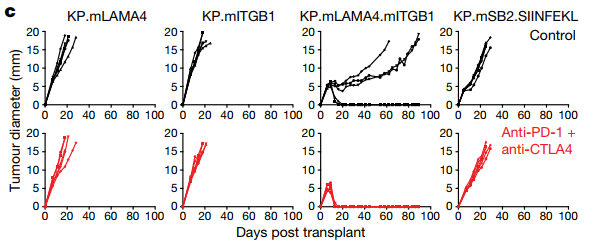
只有第三組:同時表達兩種新抗原的腫瘤,能夠被聯合免疫治療幹掉,說明免疫應答的激活,兩類新抗原缺一不可
只表達mITGB1或者mLAMA4的腫瘤,治療後都不會消失,也就是說在研究團隊營造的戰場中,不管是效應T細胞還是輔助T細胞,識別抗原後,都不足以單獨激活足夠的抗腫瘤免疫。它們必須得同時找到相應的目標,然後協同作戰才行。
T細胞亞群測定顯示,浸潤腫瘤的輔助性T細胞,亞型上74%是1型,和此前的研究相符。輔助性T細胞不僅可以使浸潤腫瘤的效應T細胞數目增加,還能幫助它們增強殺傷力,數量質量兩方面都有提高。
等等,這聽著好像是輔助性T細胞的正常職責吧?一定要腫瘤表面有MHC II類新抗原,把輔助性T細胞從後方拉到前線,才能激活清除腫瘤的強力應答嗎?
為了搞清這一點,研究團隊在小鼠腹部的左右兩側分別植入了腫瘤,左側的癌細胞同時表達兩種新抗原,右側的只表達mLAMA4,這就意味著輔助性T細胞只會在左側腫瘤中識別抗原並發揮作用,右側戰場就是效應T細胞獨挑大樑了。

在同一隻小鼠身上做兩個腫瘤的試驗,說服力就強了
事實證明,沒有指揮官的部隊打不了勝仗:小鼠左腹,同時表達兩種新抗原的腫瘤,直接在註射免疫檢查點抑製劑後被消滅了,而右腹只表達mLAMA4的腫瘤,接受同樣的治療,卻僅僅是生長速度被拖慢了一點。差距真的有,不服不行。
實驗還顯示,輔助性T細胞還對維持小鼠的免疫記憶有著重要作用,不過它也不能當光桿司令。如果把這次實驗中的輔助性T細胞單獨注射到腫瘤部位,也就是採用與2014年《科學》上論文相似的過繼性細胞療法,一樣控制不了腫瘤。
這一系列精彩的過程,倒不是只有輔助性T細胞和效應T細胞兩位演員。實驗中有一類巨噬細胞(iNOS+)的數量也暴增了83倍,研究團隊認為,巨噬細胞可能是被輔助性T細胞分泌的干擾素-γ招募,增援了T細胞的作戰。

作戰地圖上的“藍方”是T細胞,面對“紅方”癌細胞,“藍方”還有紫色、黃色和綠色的不同免疫細胞當幫手
(圖片來源:聖路易斯華盛頓大學)
從坐鎮帥位到帶頭衝鋒,這研究也算顛覆了過往對輔助性T細胞的認知。正如論文的通訊作者,聖路易斯華盛頓大學教授Robert Schreiber所說:“與效應T細胞相比,輔助性T細胞在免疫治療上的研究和應用,落後得太多了。”
“免疫檢查點抑製劑和腫瘤疫苗同時使用,是有不少先例的,但我們用激活輔助性T細胞的抗原當疫苗,效果要比此前的都好。我們希望它能把免疫檢查點抑製劑療法的客觀緩解率,從20%(單獨使用)提升到70%。 ”[7]
輔助性T細胞出手,讓效應T細胞的殺傷力更上一層樓,如果真能轉化到臨床,絕對讓人期待啊。
1.Alspach E, Lussier DM, Miceli AP, et al. MHC-II neoantigens shape tumour immunity and response to immunotherapy[J]. Nature, 2019.
2.Gubin MM, Zhang X, Schuster H, et al. Checkpoint blockade cancer immunotherapy targets tumour-specific mutant antigens[J]. Nature, 2014, 515(7528): 577.
3.Haslam A, Prasad V. Estimation of the percentage of US patients with cancer who are eligible for and respond to checkpoint inhibitor immunotherapy drugs[J]. JAMA Network Open, 2019, 2(5): e192535-e192535.
4.Tran E, Turcotte S, Gros A, et al. Cancer immunotherapy based on mutation-specific CD4+ T cells in a patient with epithelial cancer[J]. Science, 2014, 344(6184): 641-645.
5.Kreiter S, Vormehr M, Van de Roemer N, et al. Mutant MHC class II epitopes drive therapeutic immune responses to cancer[J]. Nature, 2015, 520(7549): 692.
6.Ott PA, Hu Z, Keskin DB, et al. An immunogenic personal neoantigen vaccine for patients with melanoma[J]. Nature, 2017, 547(7662): 217.
7.https://medicine.wustl.edu/news/clues-to-improve-cancer-immunotherapy-revealed/
頭圖來源:《科學》