[vc_row][vc_column][vc_column_text]來源:奇點網
癌症治療的進步,並不只單純體現在新藥的層出不窮上。挖掘現有藥物的潛力,盡量實現療效的最大化,同樣是一種不可或缺的進步。
舉個例子吧,抗血管生成類藥物大家都熟悉。隨著時間推移,同一種靶向藥物治療同一種癌症的生存期數據,可能在不同試驗中是越來越長的。這種現象,不就是現有藥物應用進步的體現嗎?
藥物應用的進步,就讓抗擊癌症有了新的可能和期望。近年來在晚期結直腸癌的治療當中,就掀起了一波“轉化治療”的新浪潮。這波後浪,到底是怎樣的呢?
從延長生命,到爭取治癒的治療目標轉變
在所有癌症當中,結直腸癌也算是兇名赫赫的狠角色了。但跟肺癌、胃癌等癌症不同,即使是到了轉移性晚期的階段,結直腸癌患者也仍然有實現治癒的機會。這是因為,結直腸癌的遠處轉移,最早也最常出現在肝臟。
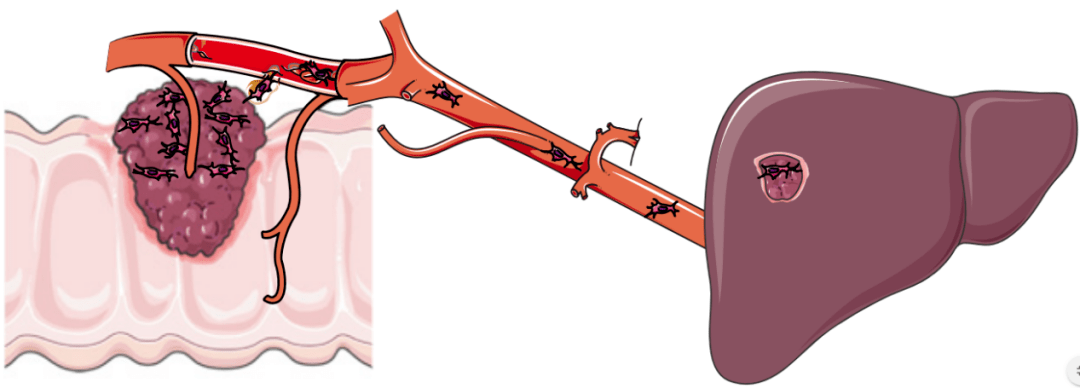
結直腸癌的肝轉移
(圖片來源:Gut)
如果轉移灶僅局限在肝臟,患者就沒有失去手術的機會,手術後的預後也不錯, 5年生存率能達到40%,10年生存率也有近25%,而且大多數長期生存的患者,都能實現無瘤生存,就相當於治癒了 [1-2]。
因此對存在遠處轉移的患者,治療思路得從盡量延長生存,轉變成通過手術為主的治療,爭取更好的預後才行。不過可以直接動手術的患者,大概只佔全部存在肝轉移的腸癌患者的20%,還有一部分患者適合立體定向放療等局部治療[3]。
剩下的患者治療該如何進行,目前還是臨床的一個疑難點。從理論上說,這些患者都應該接受多學科團隊(MDT)的嚴格評估,根據轉移灶情況、身體條件等要素精準選擇治療方案,比如腫瘤“潛在可切除”的患者,就應該嘗試“轉化治療”。
轉化治療的定義,近年來隨著治療手段的豐富也有了發展和變化:轉化治療是對初始時不適合,或無法進行局部治療(包括手術、消融、放療等)的患者,通過一系列有效的全身治療,使患者可以通過局部治療,達到無疾病狀態(NED)。
這裡的全身治療,主要是指化療和靶向藥物的聯合治療方案,要通過它們實現縮小原發灶、控制肝轉移灶等目標。而無疾病狀態,則是指治療後檢查未發現腫瘤殘餘,有些類似完全緩解(CR)。
但在臨床實踐中,並不是每個患者都能接受MDT評估的,就連“潛在可切除”的標準也並不明確。這就讓治療方案“參差不齊”,可能使很多患者因為治療強度不足,無法成功實現轉化,或者因為沒有MDT評估,而錯過了手術時機。
沒有MDT,就可能會出現很多患者一直接受化療,而不適時調整方案的情況
(圖片來源:Pixabay)
這種遺漏患者、錯失時機的問題,可能會使至少10%的患者,失去轉化治療成功的機會,影響是非常大的[4]。那麼有沒有一個簡潔實用,適合多數患者的統一治療思路呢?
命由天定,運在人為
“以力破巧”,在初始治療中對所有符合條件的患者,使用療效強烈的方案以爭取手術機會,就是個很好的思路。
雖然結直腸癌的轉化治療,目前還屬於方興未艾的課題,專門的研究並不多,但還是有一條原則被普遍認可的—— 初始治療方案的客觀緩解率(ORR)較高,轉化治療成功的可能性也就比較大。
要想做到這一點,就得看化療和靶向治療的聯合使用,現在這種聯合治療,已經在結直腸癌的一線治療中站穩了腳跟,貝伐珠單抗(Bevacizumab)、西妥昔單抗(Cetuximab)等藥物,與化療聯合使用都能充分放大療效[5-6]。
拿和各種化療“百搭”的貝伐珠單抗來說,它聯合化療一線使用時的客觀緩解率(ORR)已經突破60%,有效改善了患者的預後 [5-6]。此外免疫檢查點抑製劑,以及一些方興未艾的新型靶向藥物,也有望在未來成為轉化治療的新選擇。
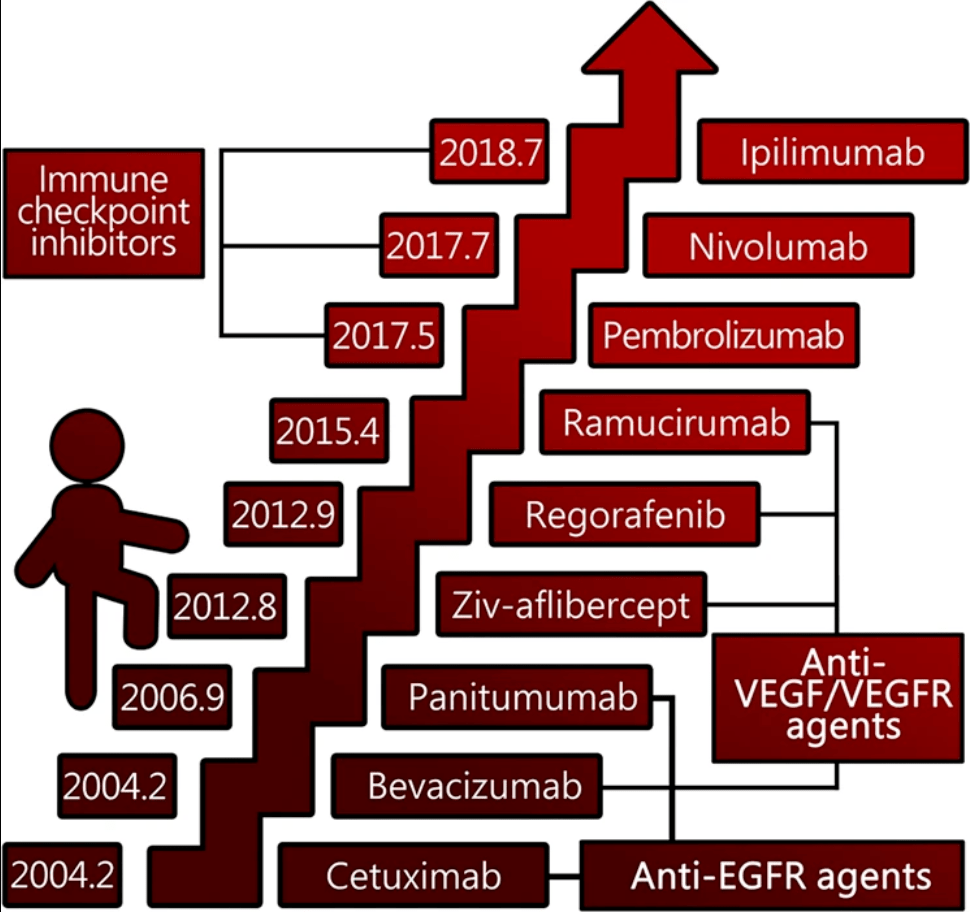
結直腸癌靶向治療和新療法演變史
(圖片來源:Signal Transduction and Targeted Therapy)
身體狀態尚可,能耐受治療的患者,就適合採取強有力的化療+靶向治療作為初始方案。當然除了身體狀態,患者的轉移灶數目、部位、手術切除的可行性等“技術性指標”,此前也是評估是否適用轉化治療的重要標準。
但現在的評估標準,已經轉向對腫瘤生物學行為的關注,加入基因和分子層面的考量了。比如左半結腸癌和右半結腸癌的差異、是否存在RAS/RAF突變等等,從而提示靶向治療和化療的具體用藥方案。
不管怎麼說,轉化治療都要圍繞著患者對治療的反應來開展。如果說患者的腫瘤生物行為學決定了“命”,是醫生初始不能去把握的,那麼圍繞治療反應,盡量採取最有力的初始治療,給患者治癒的希望,就是醫生可以去把握的“運”了。
那麼在轉化治療的武器庫中,都有哪些打擊方案可用,它們的療效又各是怎樣的呢?
“百搭”百戰
在2016年歐洲腫瘤內科學會(ESMO)轉移性結直腸癌診療指南列出的轉化治療推薦方案中,有一大半都是多藥化療聯合貝伐珠單抗。說起來,貝伐珠單抗在結直腸癌的一線治療中也的確是“百搭”,和任何化療方案都能搭配。

轉化治療成功,就能給醫生更多施展手術技巧的舞台
(圖片來源:Pixabay)
而最近幾年頗受關注的治療選擇,是由貝伐珠單抗搭檔氟尿嘧啶+奧沙利鉑+伊立替康三種藥物組成的FOLFOXIRI+Bev方案,它在一線治療中風頭正勁,在轉化治療中也已經有一些初步的成果。
2017年,一篇發表在JAMA Oncology上,列入11項研究和889名患者的Meta分析顯示,FOLFOXIRI+Bev方案治療的客觀緩解率可達69%,轉化到手術切除的比例則是39.1%,其中28.1%的患者實現了根治性的R0切除。
患者整體的中位生存期(OS),則為30.2個月。雖然這一數字並未明顯優於FOLFOXIRI+Bev方案的其它一線治療試驗數據,但這與Meta分析列入的患者情況復雜,影響預後的不良因素較多也有關[7]。
而且即使是一線治療未能實現轉化目的,也不意味著患者就沒有了機會。最近兩年公佈結果的VISNU-1/TRIBE-2兩項大型試驗數據顯示,FOLFOXIRI+Bev方案還可以跨線使用,繼續以成功轉化為目標。
也就是說,即使一線治療出現疾病進展,強力的FOLFOXIRI+Bev方案仍然有望爭取二線轉化。比如在VISNU-1試驗中,FOLFOXIRI+Bev二線治療的客觀緩解率仍能達到19%,那麼就不應該放棄為這些患者爭取手術機會的可能[8-9]。
要注意,客觀緩解率和轉化成功率,並不等於實際接受手術的患者佔比
(圖片來源:Pixabay)
在最新的《中國臨床腫瘤學會(CSCO)結直腸癌診療指南2020版》中,FOLFOXIRI+Bev方案用於轉化治療的效果也得到了認可,在“潛在可切除”患者轉化治療方案的推薦級別,從II級提升到了I級。
除了貝伐珠單抗之外,西妥昔單抗、帕尼單抗(panitumumab)等靶向EGFR的藥物配合化療使用,也是常見的選擇,但這套方案在結腸癌中,卻因為腫瘤生物學行為特點,療效呈現明顯的左右有別。
EGFR單抗+化療的方案,在轉化左半結腸癌時效果比較明顯,但右半結腸癌由於RAS/RAF基因突變的發生率較高,會使療效大打折扣,需要提前進行基因檢測來確認;而貝伐珠單抗配合化療,則是能夠實現“通吃”的 [9]。
而對於存在微衛星不穩定性高/錯配修復缺陷(MSI-H/dMMR)的患者,免疫治療可能會是更好的選擇,近期在美國臨床腫瘤學會(ASCO)年會上公佈的數據顯示,PD-1抑製劑一線治療這類患者的客觀緩解率,就優於現有的化療。
看看,新方案新療法層出不窮,所以轉化治療掀起的這波浪潮,注定會變革晚期結直腸癌的治療範式。給更多符合“潛在可切除”條件的患者,爭取手術治愈、長期生存的機會,為患者的命運帶來改變,本來就該是臨床實踐的重要目標啊。
僅限寡轉移?僅限一線治療?隨著治療方案的發展,轉化治療的邊界也在擴大,這些舊觀念都在慢慢發生動搖。唯有以終為始,才能“變,不設限”。

1.Rees M, Tekkis PP, Welsh FKS, et al. Evaluation of long-term survival after hepatic resection for metastatic colorectal cancer: a multifactorial model of 929 patients[J]. Annals of Surgery, 2008, 247(1): 125 -135.
2.Kanas GP, Taylor A, Primrose JN, et al. Survival after liver resection in metastatic colorectal cancer: review and meta-analysis of prognostic factors[J]. Clinical Epidemiology, 2012, 4: 283.
3.Valderrama-Treviño AI, Barrera-Mera B, Ceballos-Villalva JC, et al. Hepatic metastasis from colorectal cancer[J]. Euroasian journal of hepato-gastroenterology, 2017, 7(2): 166.
4.Österlund PJ, Salminen T, Algars A, et al. Patient characteristics associated with poor performance status, ECOG 2-3, and effect on survival in 1086 Finnish metastatic colorectal cancers (mCRC) nationwide (prospective RAXO study)[J]. Annals of Oncology, 2019, 30: v245.
5.Van Cutsem E, Cervantes A, Adam R, et al. ESMO consensus guidelines for the management of patients with metastatic colorectal cancer[J]. Annals of Oncology, 2016, 27(8): 1386-1422.
6.Xie YH, Chen YX, Fang JY. Comprehensive review of targeted therapy for colorectal cancer [J]. Signal Transduction and Targeted Therapy, 2020, 5(1): 22.
8.Cremolini C, Loupakis F, Antoniotti C, et al. FOLFOXIRI plus bevacizumab versus FOLFIRI plus bevacizumab as first-line treatment of patients with metastatic colorectal cancer: updated overall survival and molecular subgroup analyses of the open-label, phase 3 TRIBE study [J]. The Lancet Oncology, 2015, 16(13): 1306-1315.
9.Cremolini C, Antoniotti C, Rossini D, et al. Upfront FOLFOXIRI plus bevacizumab and reintroduction after progression versus mFOLFOX6 plus bevacizumab followed by FOLFIRI plus bevacizumab in the treatment of patients with metastatic colorectal cancer (TRIBE2): a multicentre, open-label , phase 3, randomised, controlled trial[J]. The Lancet Oncology, 2020.
10.Arnold D, Lueza B, Douillard JY, et al. Prognostic and predictive value of primary tumour side in patients with RAS wild-type metastatic colorectal cancer treated with chemotherapy and EGFR directed antibodies in six randomized trials[J]. Annals of Oncology , 2017, 28(8): 1713-1729.
[/vc_column_text][/vc_column][/vc_row]



