他們發現兩種常見的功能獲得性促癌p53突變,實際上有很強的抑癌能力,甚至比正常p53更強,只不過在腸道微生物代謝產物沒食子酸等的影響下,這兩種突變型p53超強的抑癌能力被完全消除,最終導致腫瘤進展不受控制 [1]。
Ben-Neriah團隊的這個發現不僅解釋了為什麼小腸癌很罕見,但結直腸癌卻是人類因癌症死亡的主要原因;還證實了促癌基因突變其實有很強的可塑性,以及攜帶這些突變的細胞所處的微環境,決定了突變的真正功能。

▲論文截圖
在醫學界,有個問題一直困擾著醫生們,那就是腸癌為什麼好發於結直腸(佔98%),而小腸癌卻非常罕見(2%)[2]。
Ben-Neriah團隊也一直在思考這個問題,他們覺得可能是腸道微生物在背後搗鬼,因為相較而言,小腸腸道微生物少,而結直腸微生物非常豐富。
為了檢驗上述猜測,Ben-Neriah和他的同事將兩個人類中最常見的p53突變(R175H和R273H,對應小鼠p53的R172H和R270H)[3]引入小鼠腸道。我們都知道p53是重要的抑癌蛋白,由TP53基因編碼,而p53的功能缺失突變以及功能獲得突變,是癌症發生和進展的重要原因。
為了嚴謹起見,研究人員將p53突變引入到兩種WNT驅動的腸癌小鼠模型中(ApcMin/+和Csnk1a1腸道誘導缺失)。結果讓他們興奮,因為非常好的再現了醫生在臨床上觀察到的現象:p53突變的引入,在不同的腸段表現出截然相反的表型,結腸和迴腸(遠端腸道)上皮高度發育不良和增生,而十二指腸和空腸(近端腸道)則表現出正常的增生水平。
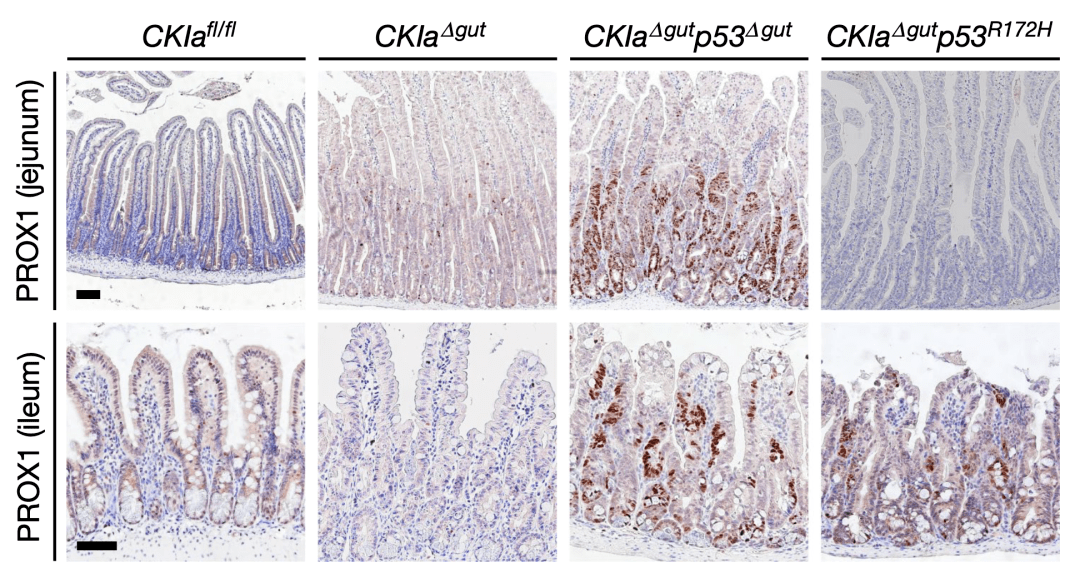
▲空腸(上)和迴腸(下)受突變型p53的影響
進一步研究小鼠腸道的腫瘤形成特點之後,研究人員認為,突變型p53的促癌作用似乎在某些條件下被反轉了。
這究竟是為什麼呢?
在正常情況下,沒有發生突變的p53蛋白是通過轉錄激活抗增殖和促凋亡基因(如:p21和Bax)發揮抑癌的作用[4],那Ben-Neriah團隊引入的突變p53可能是重新獲得了轉錄激活作用[5]。
不過,研究結果推翻了這一猜想。因為與沒有突變的p53相比,有R172H突變的p53與染色質的相互作用幾乎完全被消除,根本沒辦法實現轉錄激活。基於這個數據,研究人員認為,突變p53在空腸中的腫瘤抑製作用不是基於轉錄激活。
在另一種ApcMin/+小鼠模型中,研究人員發現了一樣的規律:p53 R172H突變的引入,導致結腸腫瘤發生增多,但減輕了近端腸道的腫瘤負擔。
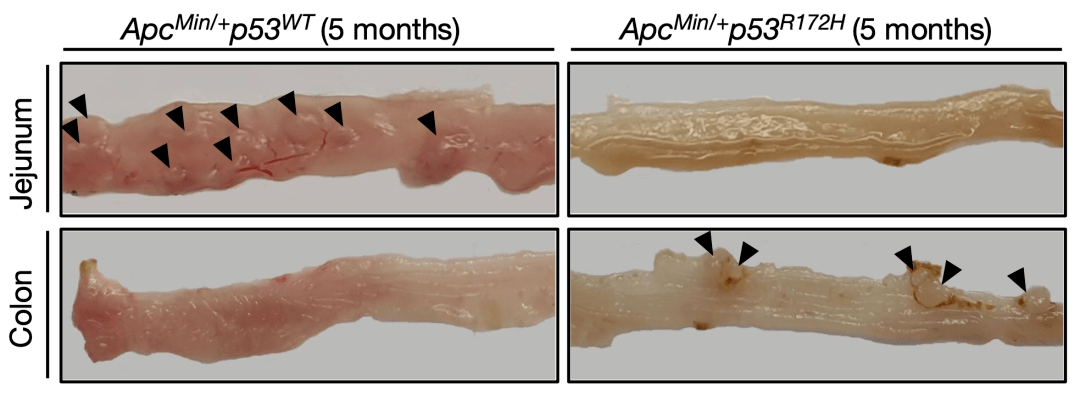
▲在另一個模式小鼠的空腸和結腸再現之前的研究成果
既然突變的p53抑癌作用與正常p53不一樣,那麼這背後的機制究竟是什麼呢?
在後續的研究中,Ben-Neriah和他的同事發現,本研究引入的突變型p53能減少轉錄因子TCF4與染色質的結合,進而抑制WNT通路的激活,最後實現抑制腫瘤發生和生長的作用。
而且他們還通過將突變的p53轉到腺瘤類器官中,研究了突變型p53的抑癌作用,結果顯示突變型p53的抑癌效果遠強於正常p53。
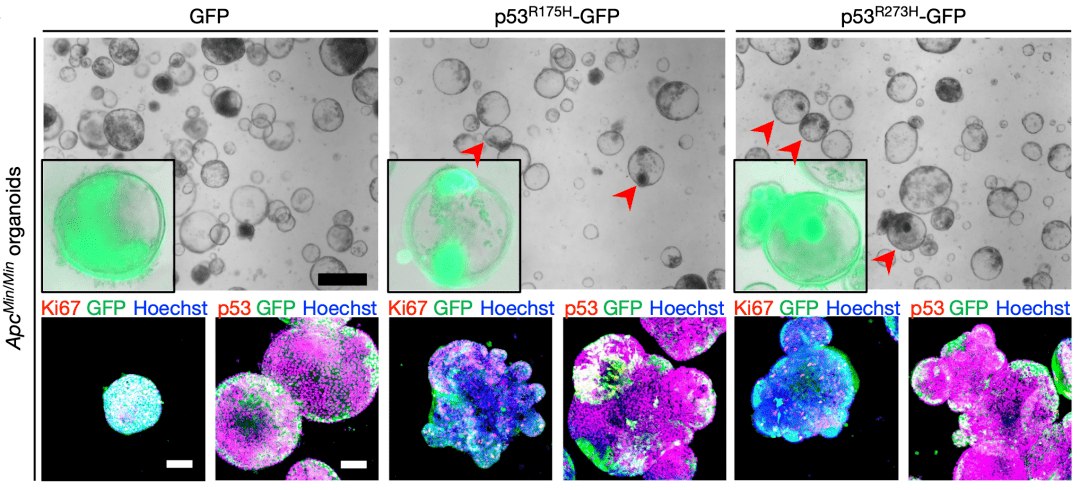
▲類器官研究證實了突變型p53超強的抑癌能力
此外,研究人員還發現,突變型p53在迴腸中似乎也能發揮抑癌作用。這表明,是時候研究腸道微生物對p53功能的影響了。
最直接的辦法就是用抗生素清除腸道微生物,而且這個操作效果非常顯著。
研究人員注意到,只有轉入突變型p53的小鼠受抗生素的影響:用抗生素之後,結腸和迴腸中觀察到的發育不良消失了,而且腸道的健康狀態也變得更好了。

▲抗生素(ABX)對突變型p53表型的影響
從分子和細胞水平上看的話,使用抗生素之後,攜帶突變型p53的腸道細胞促癌的WNT通路激活減少,迴腸和結腸中的細胞增殖減少。
以上數據表明,確實是腸道微生物將突變型p53的強力抑癌作用轉換成了促癌作用。
那麼腸道微生物又是如何做到的呢?
按照以往的經驗,問題應該出現在腸道微生物的代謝產物上。
於是Ben-Neriah和他的同事對小鼠腸道微生物代謝產物做了篩選,並分成4大類:短鏈脂肪酸(丁酸鹽和己酸鹽等)、脂質衍生物(脫氧膽酸鹽等) 、異硫氰酸鹽(sulforaphane等)和多酚類(尿石素B,鞣花酸和沒食子酸等)。
然後分別用四類代謝產物處理攜帶突變型p53的腫瘤類器官,觀察類器官形態、增殖能力,以及WNT通路活性的變化。
結果只有多酚類代謝產物有作用。進一步深入研究之後,將目標縮小到了沒食子酸。
也就是說,只有沒食子酸能提高攜帶突變p53類器官的增殖能力,和WNT通路的活性。更重要的是,沒食子酸的這種能力是特異性的。而且,除去沒食子酸4天之後,攜帶突變型p53的腫瘤類器官,就失去了增殖能力,形態恢復正常,WNT通路的活性也下降。
這說明,沒食子酸的持續存在是消除突變型p53抑癌能力所必需的。

▲持續供應沒食子酸(GA)和去除沒食子酸對類器官形態的影響
隨後研究人員在體內探索了沒食子酸的分佈,滿是細菌的迴腸果然比細菌稀少的空腸濃度高,這也間接證實了之前的發現。
據了解,目前已經在人體內發現兩種能產生沒食子酸的細菌,它倆是植物乳桿菌和枯草芽孢桿菌 [6]。這兩種細菌主要利用莽草酸脫氫酶(SDH)合成沒食子酸[7]。
研究人員還分析了小鼠空腸、迴腸和結腸中SDH基因的豐度,也確實是空腸少,迴腸和結腸多。
當研究人員用沒食子酸餵食被抗生素處理過的突變型p53小鼠之後,突變型p53的抑癌活性就完全消失了,小鼠的迴腸和結腸變得過度增生,出現豐富的高等級發育不良灶,WNT通路的基因在整個迴腸和結腸中被高度激活。
總的來說,這個研究表明p53突變具有很強的可塑性,而且腸道微生物在塑造p53突變功能方面有重要作用。
“從科學上講,這是一個新領域,”Ben-Neriah說[2],“微生物組對癌症突變影響的程度讓我們吃驚,在某些情況下,甚至是完全改變了突變的性質。”
這個研究提示,那些結直腸癌高危人群可能要關注他們腸道菌群的變化,並且在吃沒食子酸含量豐富的食物時,需要三思而行。
參考文獻:
[2].https://www.eurekalert.org/pub_releases/2020-07/thuo-pdt072820.php
[3].Sabapathy K, Lane D P. Therapeutic targeting of p53: all mutants are equal, but some mutants are more equal than others[J]. Nature Reviews Clinical Oncology, 2018, 15(1): 13-30.
[4].Vousden KH, Prives C. Blinded by the Light: The Growing Complexity of p53[J]. Cell, 2009, 137(3): 413-431.
[5].Bullock AN, Fersht A R. Rescuing the function of mutant p53[J]. Nature Reviews Cancer, 2001, 1(1): 68-76.
[6].Chen H, Hayek SA, Guzman JR, et al. The Microbiota Is Essential for the Generation of Black Tea Theaflavins-Derived Metabolites[J]. PLOS ONE, 2012, 7(12).
[7].Muir RM, Ibanez AM, Uratsu SL, et al. Mechanism of gallic acid biosynthesis in bacteria (Escherichia coli) and walnut (Juglans regia)[J]. Plant Molecular Biology, 2011, 75(6): 555- 565.