真不知道人體還有多少神奇的秘密等著科學家去發現。
前不久,美國紐約大學醫學院微生物學家Ken H. Cadwell和Victor J. Torres領銜的研究團隊,在頂級期刊《自然》上發表的重磅研究成果[1],再一次刷新了我對人體先天性免疫的認知。
他們發現,人體細胞在發現超級耐藥菌的DNA之後,竟然會把細胞膜表面能被細菌毒素結合的蛋白以外泌體的形式分泌出去。如此以來,超級細菌釋放的殺傷性毒素就被外泌體誘捕了,讓細胞躲過一劫。
不得不說,咱們人體細胞這招“壁虎斷尾”的手段,實在是高明極了。
研究人員認為,他們可能發現了一種對抗細菌感染的全新先天性免疫機制 [2]。
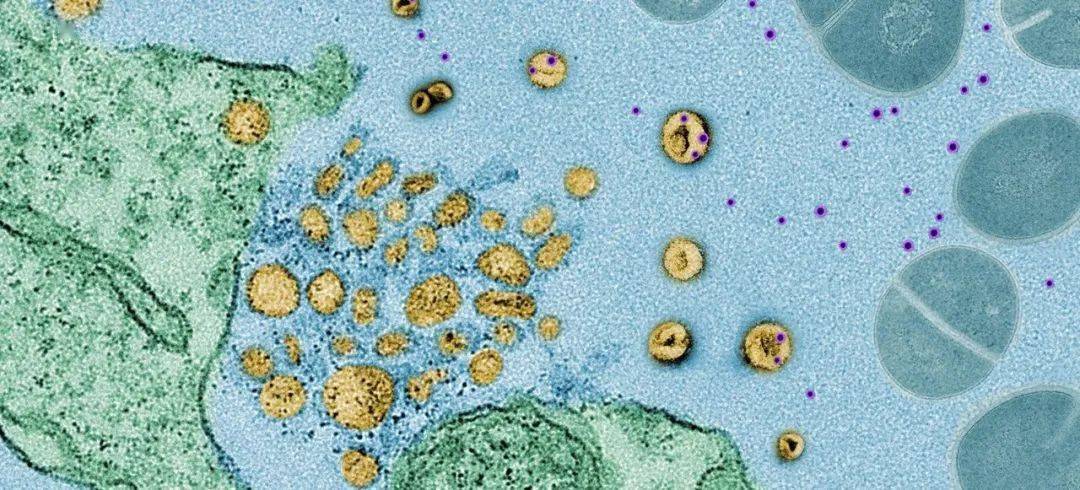
▲ 細菌與細胞之間的攻防大戰:黃色是外泌體,紫色是毒素,藍色是細菌
耐甲氧西林金黃色葡萄球菌(MRSA)是一種常見的超級細菌,對很多抗生素產生了耐藥性。它能通過分泌孔道形成毒素(PFTs)破壞宿主的細胞膜,導致宿主細胞死亡 [3]。
不過研究人員觀察到一個現象,在美國大約有五分之一的人身上有MRSA,但是死於MRSA感染的人極少,大約在萬分之一左右[4]。
這促使Cadwell和Torres思考一個問題:在人體內是不是也存在一種可以中和孔道形成毒素的先天性免疫機制呢?

▲ Victor J. Torres(圖源:med.nyu.edu)
基於之前的研究,Cadwell和Torres已經知道,細菌分泌的孔道形成毒素會與細胞表面的金屬蛋白酶ADAM10結合,導致細胞膜穿孔 [5]。而在五年前,Cadwell和Torres已經聯手發現細胞的自噬蛋白ATG16L1能保護細胞免遭MRSA孔道形成毒素(α-毒素)的傷害 [6]。
那麼自噬蛋白ATG16L1、金屬蛋白酶ADAM10和孔道形成毒素之間究竟是什麼關係呢?背後會不會隱藏著一種鮮為人知的先天免疫機制呢?
要搞清楚上面的兩個問題,就得先在細胞內理清ATG16L1和ADAM10之間的關係。

▲ Ken H. Cadwell(圖源:med. nyu. edu )
Cadwell和Torres團隊首先在人肺泡上皮細胞系中抑制ATG16L1基因的表達,結果ADAM10的表達水平升高了。用純化的α-毒素處理ATG16L1基因表達水平低的細胞,導致細胞大量死亡;而ADAM10基因表達被抑制的細胞,則對α-毒素有抗性。
這個結果表明,α-毒素受體ADAM10的表達水平是受ATG16L1負調控的。簡單地講,ATG16L1通過降低細胞表面ADAM10的數量,讓細胞對MRSA分泌的α-毒素有了抗性。
那這個過程是如何發生的呢?
由於ATG16L1是個自噬蛋白,研究人員首先想到的自噬,即ATG16L1調集自噬通路,把ADAM10降解了。不過,Cadwell和他的同事卻發現,ATG16L1降低ADAM10的水平,與自噬沒有一丁點兒關係。
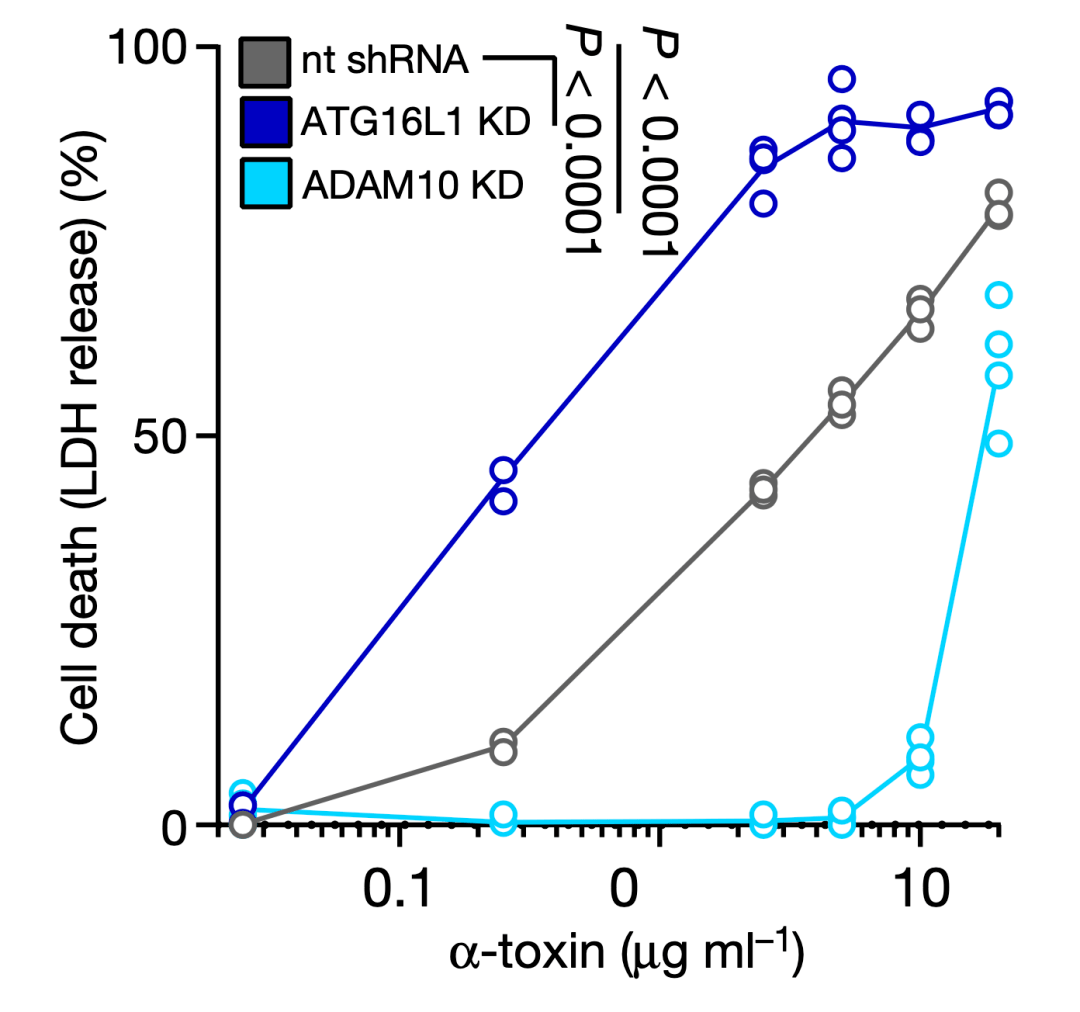
▲ ATG16L1和ADAM10的表達狀況與毒素處理下細胞的死亡率
繼續查閱相關資料之後,Cadwell團隊發現,ATG類蛋白還可以促進細胞釋放外泌體 [7]。巧的是,ADAM10竟然會出現在直徑為40nm-120nm的外泌體上 [8]。
難道說ATG16L1讓細胞把α-毒素的受體ADAM10裝在外泌體表面釋放掉了?
Cadwell和他的同事迅速掉頭分析了ATG16L1表達被抑制的細胞和正常細胞分泌的外泌體的情況。
果不其然,ATG16L1表達降低之後,攜帶ADAM10的外泌體大幅減少了。而且他們還證實,ATG16L1是通過調節外泌體的形成達到降低細胞表面ADAM10的目的,而不是對ADAM10本身發生作用。
到這裡,前面提出的第一個問題基本就算說清楚了:ATG16L1通過促進外泌體的形成,降低細胞表面的ADAM10,避免細胞被α-毒素破壞。
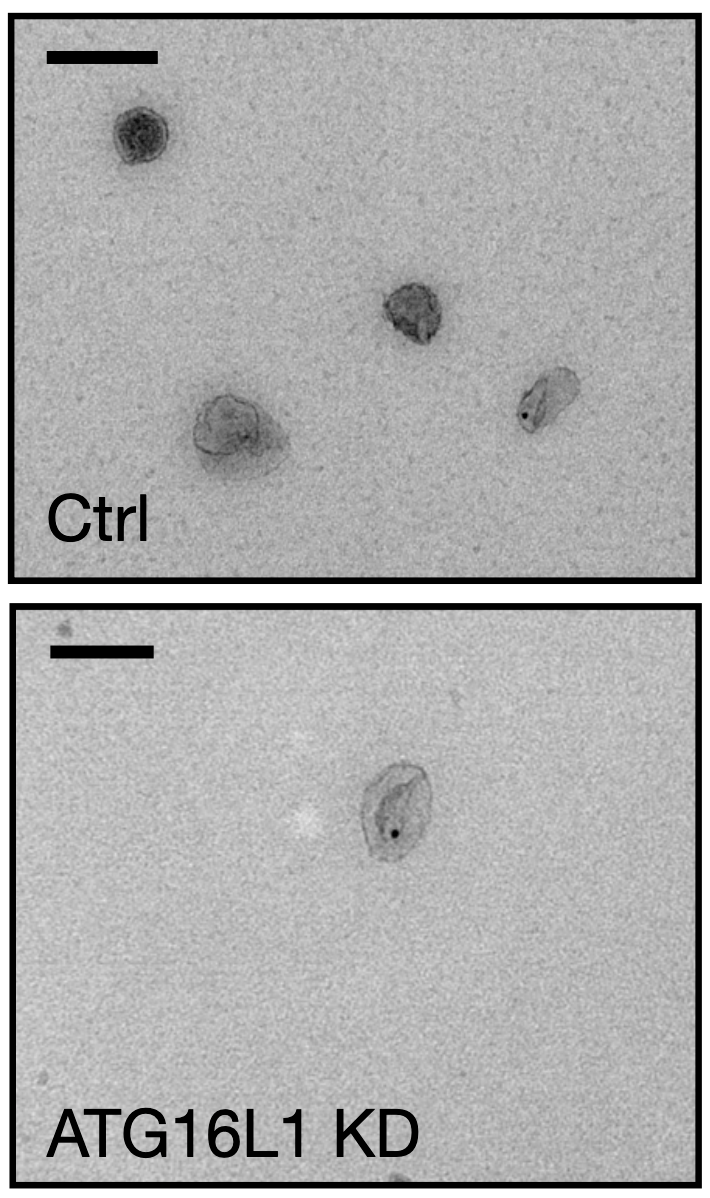
▲ ATG16L1表達水平降低,外泌體肉眼可見地減少
那麼細胞的這一過程究竟是不是受細菌感染的調控呢?
為了解決這個問題,Cadwell團隊用高溫殺死多種細菌,然後再用這些細菌刺激人和小鼠的細胞,結果外泌體的分泌都顯著增加了。在分別測試了細菌身上的多種物質之後,他們確定是細菌的DNA誘發了外泌體的大量分泌。
小鼠的實驗也證實,如果抑制ATG16L1的表達,用細菌處理也不能促進外泌體的產生。

▲ 不同的細菌處理後,外泌體的釋放都增加了
那麼細胞在感應到細菌的存在之後,釋放的外泌體究竟有沒有防禦功能呢?
研究人員分別從ATG16L1低表達和正常表達的細胞系中分離外泌體,然後用這些外泌體和α-毒素一起處理肺泡上皮細胞。結果如研究人員所料,ATG16L1正常表達的細胞產生的外泌體,對肺泡上皮細胞有保護作用,而ATG16L1低表達的細胞外泌體則沒有保護作用。
不過當加入更多ATG16L1低表達的細胞外泌體之後,這種保護作用也逐漸顯現。這再次表明,保護作用是由外泌體數量決定的。隨後的小鼠體內實驗也再次證實了上述過程。
除此之外,研究人員還發現,不同的細胞類型分泌的外泌體攜帶有不同類型的毒素受體,這也意味著不同細胞分泌的外泌體,或許可以誘捕併中和不同的細菌毒素。
▲ 吹泡泡消滅細菌(圖源:見水印)
基於以上研究,Cadwell團隊認為,他們的研究表明,細胞分泌外泌體可能是一種防禦細菌感染的全新先天性免疫反應。它通過釋放攜帶毒素結合蛋白的外泌體,誘捕細菌釋放的各種毒素,防止人體細胞或組織被細菌傷害。
Torres認為,這項研究結果不僅讓我們對哺乳動物防禦感染有了全新的認知,而且還提出了一個加強免疫系統的新策略—— 可以通過向體內註入人工的外泌體來吸收細菌毒素,或者通過促進外泌體的產生來增強人體的防禦能力 [4]。
奇點糕認為,科學真的很迷人。
編輯神叨叨
[1].Keller MD, Ching KL, Liang FX, et al. Decoy exosomes provide protection against bacterial toxins[J]. Nature, 2020, 579(7798): 260-264.
[2].Du Toit A. Distracting your enemy with bubbles[J]. Nature Reviews Microbiology, 2020, 18(5): 263-263.
[3].Dal Peraro M, Van Der Goot F G. Pore-forming toxins: ancient, but never really out of fashion[J]. Nature reviews microbiology, 2016, 14(2): 77.
[4].https://nyulangone.org/news/newfound-cell-defense-system-features-toxin-isolating-sponges
[5].Inoshima I, Inoshima N, Wilke GA, et al. A Staphylococcus aureus pore-forming toxin subverts the activity of ADAM10 to cause lethal infection in mice[J]. Nature medicine, 2011, 17(10): 1310.
[6].Maurer K, Reyes-Robles T, Alonzo III F, et al. Autophagy mediates tolerance to Staphylococcus aureus alpha-toxin[J]. Cell host & microbe, 2015, 17(4): 429-440.
[7].Cadwell K, Debnath J. Beyond self-eating: The control of nonautophagic functions and signaling pathways by autophagy-related proteins[J]. Journal of Cell Biology, 2018, 217(3): 813-822.
[8].Stoeck A, Keller S, Riedle S, et al. A role for exosomes in the constitutive and stimulus-induced ectodomain cleavage of L1 and CD44[J]. Biochemical Journal, 2006, 393(3): 609-618 .