[vc_row][vc_column][vc_column_text]來源:奇點網
如果說癌細胞是正常細胞對身體的背叛,那麼蛋白激酶絕對是癌變的得力助手。
人體內有超過500種蛋白激酶,我們的一舉一動都離不開它們。如果它們不工作,或者拼命工作,各種炎症、自免病、代謝紊亂,甚至是癌症就找上門了[1]。
因此,科學家把蛋白激酶作為治療癌症等疾病的重要靶點也就不難理解了。
科學家的努力沒有白費,人類社會剛剛進入二十一世紀,癌症的治療就因蛋白激酶抑製劑的出現,發生了翻天覆地的變化。
其中一個家喻戶曉的例子就是imatinib(格列衛)改變了慢性骨髓性白血病治療範式。實際上,幾乎在同一時期,在imatinib的背後,還有另一個鮮為人知的傳奇故事。
鮮為人知的故事
讓我們把時間撥回1998年。
這一年6月,人類歷史上第一個治療惡性腫瘤的細胞信號轉導抑製劑imatinib終於進入了人體試驗階段。好巧不巧,同樣是在這一年,科學家第一次提出胃腸道間質瘤(GIST)中的活化突變——受體酪氨酸激酶(KIT)活化突變——可能是GIST轉化過程中早期的事件之一 [2]。
又是蛋白激酶在作怪。
▲ GIST組織(圖源:wiki)
既然如此,那麼治療慢性骨髓性白血病的蛋白激酶抑製劑會不會對GIST也有效呢?
2000年,第一例GIST患者使用imatinib,治療效果讓人眼前一亮。隨後的臨床研究結果表明,imatinib治療無法切除和轉移性GIST安全有效,這也是靶向治療第一次在實體瘤患者身上取得成功。2002年2月美國FDA批准增加GIST為imatinib適應證[3]。
超過80%的GIST患者從imatinib單藥治療中獲益,讓imatinib再一次創造奇蹟,改寫GIST治療史。不過,仍有一半左右的患者最終還是會對imatinib耐藥 [4-6]。
儘管sunitinib和regorafenib分別獲批用於GIST的2線和3線治療,不過這兩個藥物給患者帶去的獲益有限。那有什麼方法讓患者在對imatinib耐藥之後,還能獲得更多的生存益處呢?
這得從復雜的受體酪氨酸激酶(KIT)說起。
KIT複雜的像一團亂麻
受體酪氨酸激酶(KIT)是原癌基因c-kit編碼的一類具有酪氨酸激酶活性的跨膜受體蛋白,在GIST發生髮展過程中起著十分重要的作用 [7]。
作為一個跨膜蛋白,KIT由細胞外結構域、跨膜結構域和細胞內結構域三部分組成,其中細胞內結構域又包含4個重要的部分:第一個是近膜結構域(又叫抑制開關,由11號外顯子編碼),第二個是ATP結合域(由13和14號外顯子編碼),第三個是處於ATP結合域附近的開關口袋,第四個是活化環(也叫活化環開關,由17和18號外顯子編碼)。這四個部分共同組成調控KIT活性的開關。
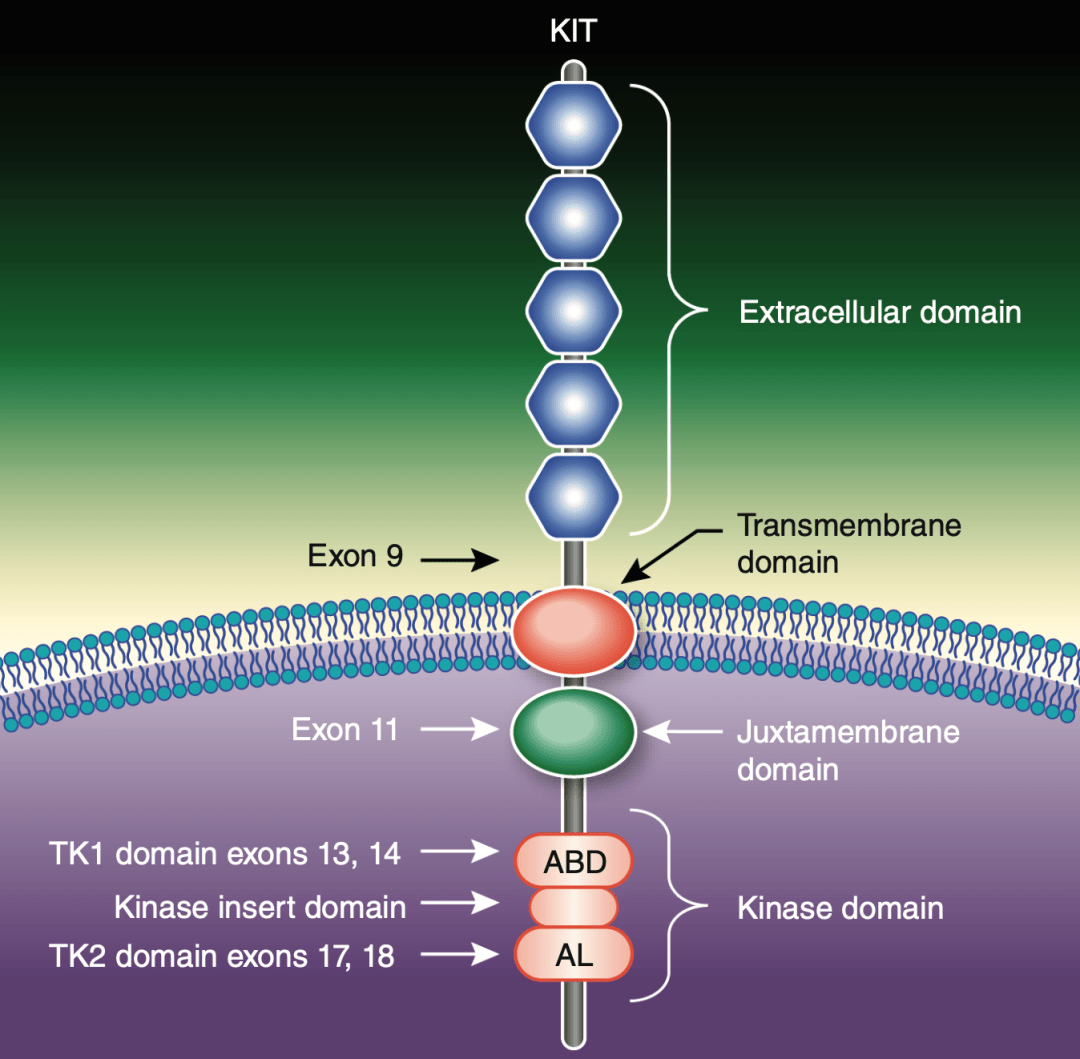
▲ KIT結構圖
別看KIT的組成很複雜,但是它工作的過程其實非常有趣。
在一般的情況下,抑制開關與開關口袋結合,KIT處於非活化狀態;特定的信號分子與KIT的胞外區域結合後,促使KIT完成二聚化[8],導致構像發生改變,抑制開關離開開關口袋,活化環與開關口袋結合,ATP結合區域暴露,ATP與KIT結合,KIT就處於激活狀態[9]。隨後,KIT將ATP的磷酸轉移給下游的蛋白,完成對下游信號通路的結合。
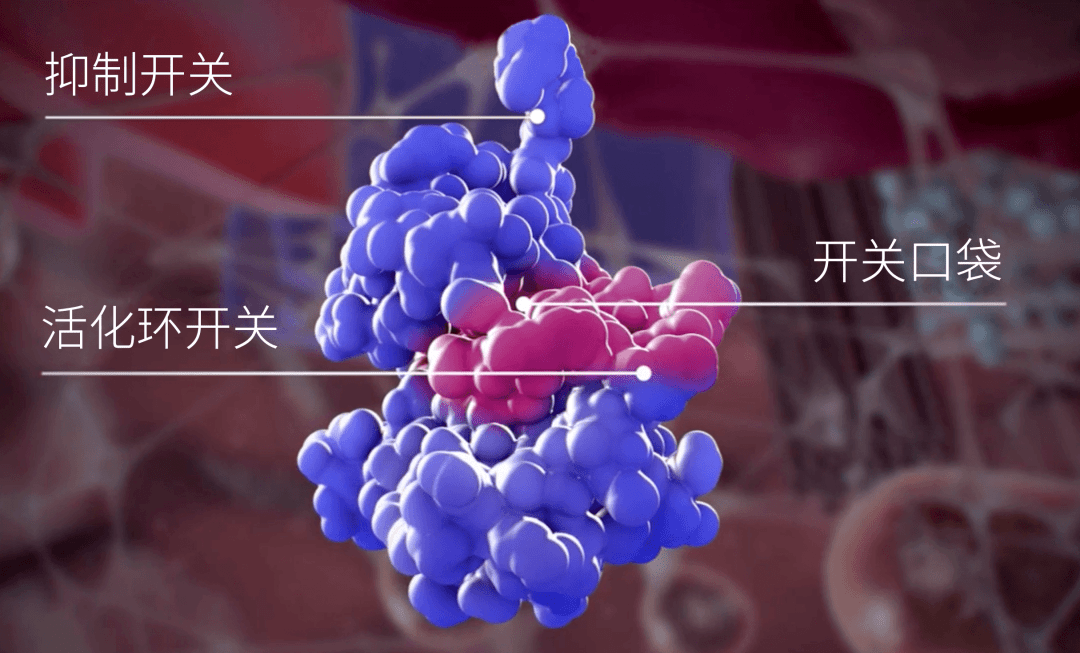
▲處於激活狀態的KIT
簡單來說,開關口袋決定了KIT是處於非活化狀態還是激活狀態,如果是抑制開關與開關口袋結合,KIT就處於非活化狀態;如果是活化環與開關口袋結合,KIT就處於活化狀態。
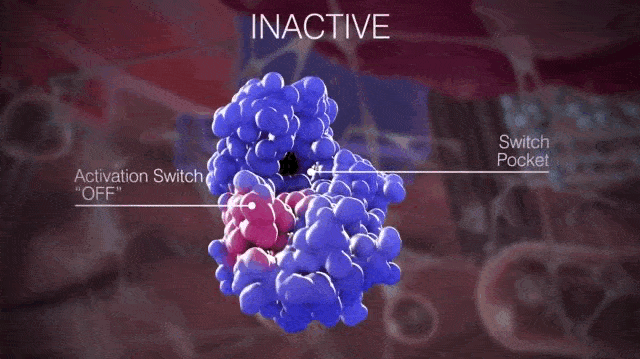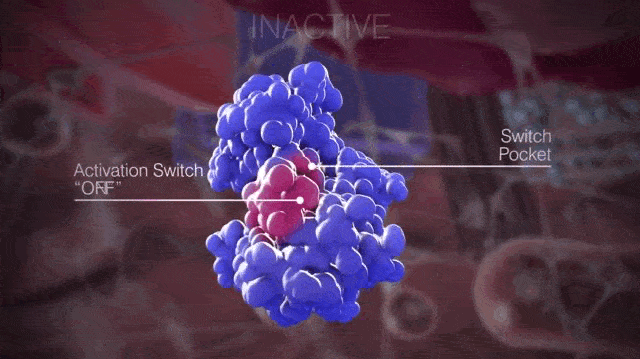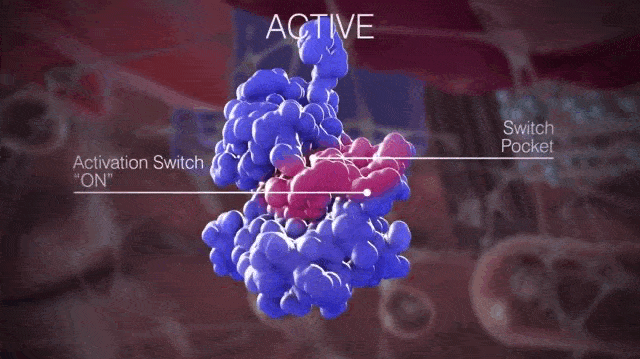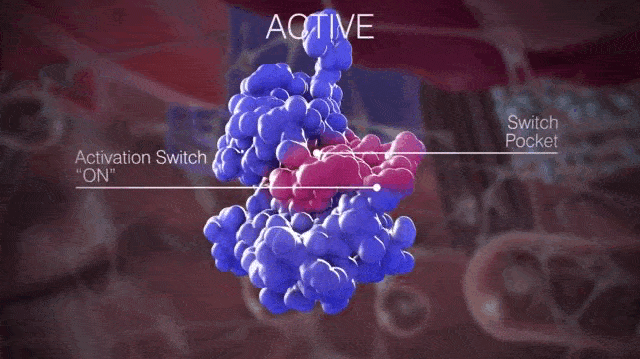
▲正常情況下KIT處於非活化狀態和激活狀態的切換
請大家仔細看上面的動圖,那個粉紅色的會動的部分就是活化環,KIT在變換結構時露出的那個“洞洞”就是開關口袋。當活化環進入開關口袋,KIT就處於活化狀態;活化環遠離開關口袋,KIT就處於非活化狀態。
道高一尺,魔高一丈
不管怎樣,看完上面的內容,你應該能感受到KIT激活調控過程之複雜、之精細、之科學。如果KIT就按照這套邏輯工作,那肯定能保證咱們人類健康無虞了。
遺憾的是,越來越多的證據表明,KIT“不安分”。
就拿GIST這種癌症來說,80%以上的確診患者體內存在KIT基因原發突變,最常見的突變出現在第11號外顯子(70%的病例)中,其次是第9號外顯子( 10%-15%) [10]。實際上,除了KIT基因之外,PDGFRA基因的突變也是GIST的驅動之一。由於PDGFRA與KIT的結構和功能類似,我們這裡就不再贅述,後文也都以KIT為例講解。
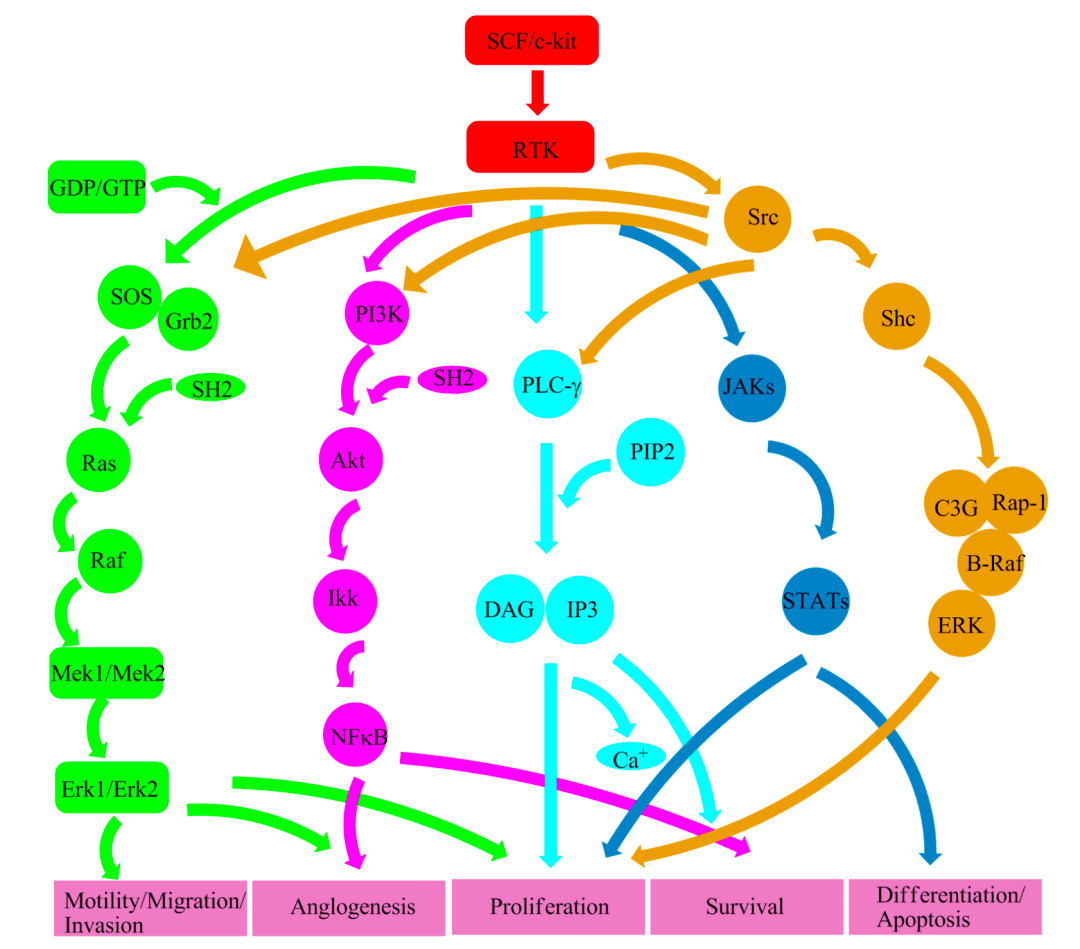
▲ KIT及下游通路
上面提到的那些突變給KIT的結構帶去了巨大的變化,導致即使KIT在沒有外界信號分子存在下,也能自行進入活躍狀態,以不可阻擋的勢頭激活下游信號通路。結果可想而知:細胞過度增殖,甚至是不死。這也就是我們常說的癌變了。
在這種情況下,要想阻斷KIT驅動癌症的進展,那就要想辦法抑制已經陷入瘋狂狀態的KIT的活性。目前的辦法是阻斷ATP與KIT結合,這樣一來,KIT的激酶結構域就沒辦法激活下游通路了。
目前已經獲批的幾個治療GIST的藥物的作用機制就是如此,它們通過與ATP競爭結合位點,阻斷ATP與KIT的結合,使KIT不能激活下游蛋白。
這種方法的效果其實還是不錯的,很多患者都能從治療中獲益。不過,仍有很多GIST患者出現耐藥。這是什麼原因呢?
對腫瘤進化稍有了解的朋友一定知道,出現耐藥大概率是因為KIT又發生了基因突變,導致ATP競爭結合抑製劑不能很好地與KIT結合,讓ATP又有了與KIT結合的機會,激活下游信號蛋白。

▲傳統ATP競爭抑製劑不能阻斷出現繼發突變KIT的激活
科學家已經發現,90%對imatinib單藥治療出現耐藥的患者,原因依舊是KIT過度激活,只不過此時的KIT過度激活是繼發性KIT突變帶來的 [11-14]。而且,這些繼發性KIT突變主要聚集在兩個區域:ATP結合口袋(外顯子13和14)和激活開關(外顯子17和18)[15]。
由於KIT的激發突變存在多樣性,因此需要一種KIT抑製劑,能夠廣譜地應對KIT出現的多種突變。
魔高一丈,道又高一尺
想要開發靶向KIT的廣譜抑製劑,就得找到激酶工作的關鍵部位。如果把激酶從非活化狀態轉變為激活狀態的過程簡化一下的話,我們不難看出整個過程其實是取決於激酶的活化環與開關口袋的相互作用。
也就是說,把重點放在活化環和開關口袋上,或許就能緩解耐藥問題。成立於2003年的腫瘤創新藥研發公司Deciphera就瞄準了這一點。基於這個思路,Deciphera的研究人員搭建了一個專門開發靶向激酶開關口袋的藥物研發平台。
據了解,目前還沒有靶向開關口袋的激酶抑製劑獲批,甚至是開展臨床試驗。也就是說,Deciphera是目前唯一一家使用這種方法開發激酶抑製劑,且已經開展臨床研究的生物製藥公司。

▲ KIT的繼發突變,以及對已獲批藥物的敏感性
靶向KIT開關口袋的Ripretinib(DCC-2618)就是其中的一個。
Ripretinib的作用機制並不難理解,一旦Ripretinib佔據了開關口袋,活化環就不能進入開關口袋,KIT自然就保持非活化狀態了。具體來講的話,Ripretinib還是挺神奇的。
大約在一年前,Deciphera的科學家在著名期刊Cancer cell 上發表了一篇研究論文[9]。在項研究成果裡,研究人員獲得了Ripretinib與KIT結合之後的X光衍射結構圖。
基於這個結構圖,研究人員發現,Ripretinib抑制KIT的活性有兩招:第一個是直接佔據開關口袋,第二個是與活化環形成了各種穩定的化學結構。在這兩招的作用下,Ripretinib 一方面可以阻止活化環進入開關口袋,另一方面還起到穩定活化環的作用,讓活化環穩定地停留在非活化狀態。
打個比方的話,這就像酒店的房門,哪怕是房門鎖壞了,但是我們把門裡面的安全栓(相當於KIT的開關口袋)鎖地死死的,門無論如何也就打不開了。

▲ KIT鑽進開關口袋,將活化環穩定在失活狀態
從目前的臨床前基礎研究數據來看,即使KIT的9、11、13、14、17和18號外顯子發生突變,以及PDGFRA的12、14和18號外顯子發生突變,Ripretinib依然高效結合到這兩個癌症驅動蛋白上,達到抗癌的目的 [16]。
不難看出,Ripretinib把KIT原發和繼發的突變基本都涵蓋在內了,它確實是個廣譜的KIT抑製劑。
2015年10月,Deciphera發起了Ripretinib治療晚期惡性腫瘤患者的安全性、耐受性1期臨床研究,確定了Ripretinib在晚期惡性腫瘤中的推薦服藥量是每日150mg。去年研究團隊發布了Ripretinib在GIST患者的二線、三線、四線及四線以上治療的數據。
從初步數據來看,150mg的給藥量表現亮眼,在GIST患者的二線治療中,中位無進展生存期是46.4週,客觀緩解率是19.4%;在三線治療中,中位無進展生存期是36.3週,客觀緩解率是14.3%;即使是在4線治療中,中位無進展生存期也能達到23.9週,客觀緩解率是7.2%[17]。
在去年9月份,Ripretinib治療四線及四線以上GIST患者的關鍵三期臨床研究INVICTUS獲得陽性數據[18],就在上週,研究數據發表在頂級醫學期刊《柳葉刀·腫瘤學》上[19]。

▲ Ripretinib(橘黃色)與開關口袋結合,導致活化環不能進入開關口袋,KIT不能被激活
在這項隨機、雙盲、安慰劑對照的國際多中心研究的三期臨床研究中,共入組129例患者,試驗組與安慰劑對照組患者的比例為2:1。結果表明,Ripretinib組與安慰劑組的mPFS分別為6.3個月(27.6週)和1個月(4.1週),Ripretinib將患者疾病進展或死亡的風險降低85%。
2020年5月15日,Ripretinib已經在美國獲得FDA批准上市,成為四線及四線以上GIST患者的標準治療藥物,5月28日又獲得NCCN指南的推薦。
不過,Ripretinib不會止步於此。目前正在開展中的三期、國際多中心、隨機、開放標籤的INTRIGUE研究 [20],就是Ripretinib向GIST的二線治療邁出的關鍵一步。
總的來說,Ripretinib靶向KIT開關口袋和活化環的雙重作用機制,讓它成為一種用於胃腸道間質瘤的廣譜酪氨酸激酶抑製劑。相較於目前已經獲批的抑製劑,Ripretinib非常讓人期待。
無論如何,希望Ripretinib的後續研究取得成功,也讓GIST患者在imatinib治療之後能有個不錯的新選擇。
有個好消息是,去年6月份,Deciphera公司與再鼎醫藥宣布Ripretinib在大中華區的獨家授權合作,再鼎醫藥將負責Ripretinib在大中華區的開發。
[2].Hirota S, Isozaki K, Moriyama Y, et al. Gain-of-function mutations of c-kit in human gastrointestinal stromal tumors[J]. Science, 1998, 279(5350): 577-580.
[3].王寧, 王斌, 王雅傑. 胃腸間質瘤:從KIT到格列衛[J]. 腫瘤, 2005, 25(5):510-513.
[4].Verweij J, Casali PG, Zalcberg J, et al. Progression-free survival in gastrointestinal stromal tumours with high-dose imatinib: randomised trial[J]. The Lancet, 2004, 364(9440): 1127-1134.
[5].Napolitano A, Vincenzi B. Secondary KIT mutations: the GIST of drug resistance and sensitivity[J]. 2019.
[6].Casali PG, Zalcberg J, Le Cesne A, et al. Ten-Year Progression-Free and Overall Survival in Patients With Unresectable or Metastatic GI Stromal Tumors: Long-Term Analysis of the European Organisation for Research and Treatment of Cancer , Italian Sarcoma Group, and Australasian Gastrointestinal Trials Group Intergroup Phase III Randomized Trial on Imatinib at Two Dose Levels[J]. 2017.
[7].Lennartsson J, Ronnstrand L. Stem Cell Factor Receptor/c-Kit: From Basic Science to Clinical Implications[J]. Physiological Reviews, 2012, 92(4): 1619-1649.
[8].Heinrich MC, Rubin BP, Longley BJ, et al. Biology and genetic aspects of gastrointestinal stromal tumors: KIT activation and cytogenetic alterations[J]. Human pathology, 2002, 33(5): 484-495.
[9].Smith BD, Kaufman MD, Lu WP, et al. Ripretinib (DCC-2618) is a switch control kinase inhibitor of a broad spectrum of oncogenic and drug-resistant KIT and PDGFRA variants[J]. Cancer cell, 2019 , 35(5): 738-751. e9.
[13].Liegl B, Kepten I, Le C, et al. Heterogeneity of kinase inhibitor resistance mechanisms in GIST[J]. The Journal of Pathology: A Journal of the Pathological Society of Great Britain and Ireland, 2008, 216(1 ): 64-74.
[14].Wardelmann E, Merkelbach-Bruse S, Pauls K, et al. Polyclonal evolution of multiple secondary KIT mutations in gastrointestinal stromal tumors under treatment with imatinib mesylate[J]. Clinical Cancer Research, 2006, 12(6): 1743 -1749.
[15].Serrano C, Mariño-Enríquez A, Tao DL, et al. Complementary activity of tyrosine kinase inhibitors against secondary kit mutations in imatinib-resistant gastrointestinal stromal tumours[J]. British journal of cancer, 2019, 120(6) : 612-620.
[16].Schneeweiss M, Peter B, Bibi S, et al. The KIT and PDGFRA switch-control inhibitor DCC-2618 blocks growth and survival of multiple neoplastic cell types in advanced mastocytosis[J]. Haematologica, 2018, 103(5 ): 799-809.
[19].Blay JY, Serrano C, Heinrich MC, et al. Ripretinib in patients with advanced gastrointestinal stromal tumours (INVICTUS): a double-blind, randomised, placebo-controlled, phase 3 trial[J]. The Lancet Oncology, 2020.
[/vc_column_text][/vc_column][/vc_row]




