癌症——全球性公共衛生挑戰
癌症是世界上致病和致死的首要原因之一,隨著世界人口的增加和人口老齡化的加劇,全球的癌症負擔預計仍將不斷增加。AACR的報告指出,到2040年,全球的癌症患者總數將達到2750萬,並且有1630萬患者因此去世。而且,相對不發達的國家將面對更沉重的癌症負擔。這一嚴峻挑戰激勵我們在癌症預防、早期檢測、療法開發和患者護理等方面需要協同作出更多努力。
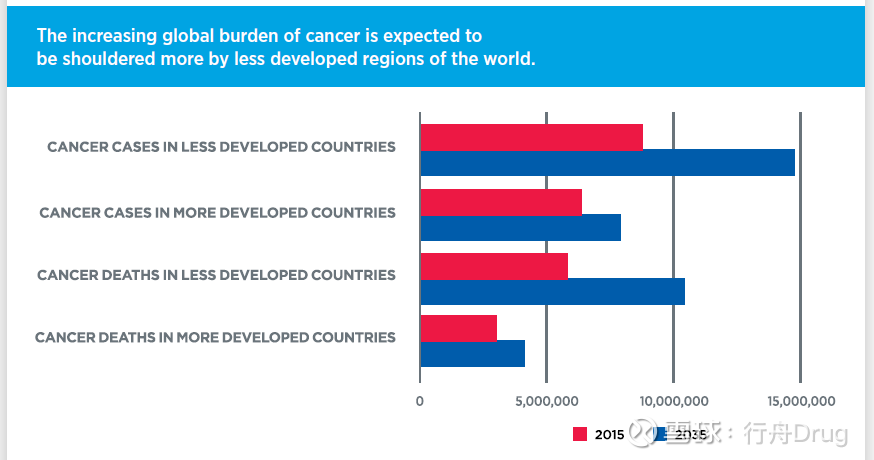
▲相對不發達的國家將面對更沉重的癌症負擔(圖片來源:參考資料[1])
科學增進了我們對癌症的理解
科學研究是我們抗擊癌症的基石。過去幾十年裡,我們在預防、發現、診斷和治療癌症方面取得了長足的進步。而且從基礎研究到轉化和臨床研究方面的突破性進展讓我們對癌症發病的原因獲得了更為深入的理解。
我們現在知道,癌症包括多種疾病類型,它們是由於控制正常細胞生長、分裂和壽命的機制失常而導致的。影響癌症發生的原因很多,在細胞內部,控制細胞正常行為的DNA發生突變,會擾亂正常的蛋白功能。這是癌症發生的首要原因。這些基因突變包括單鹼基變化、基因擴增、基因缺失、染色體結構變化、和導致表觀遺傳學變化的突變。10%的致癌突變是遺傳性或出現在身體中的所有細胞中(de novo genetic mutation)。而大部分致癌突變則是在人的一生中逐漸積累起來的。它們可能來自細胞分裂時DNA的複制錯誤,外界致癌因素導致的DNA損傷(例如吸煙和紫外光),或者其它疾病導致的慢性炎症(例如克羅恩病)。
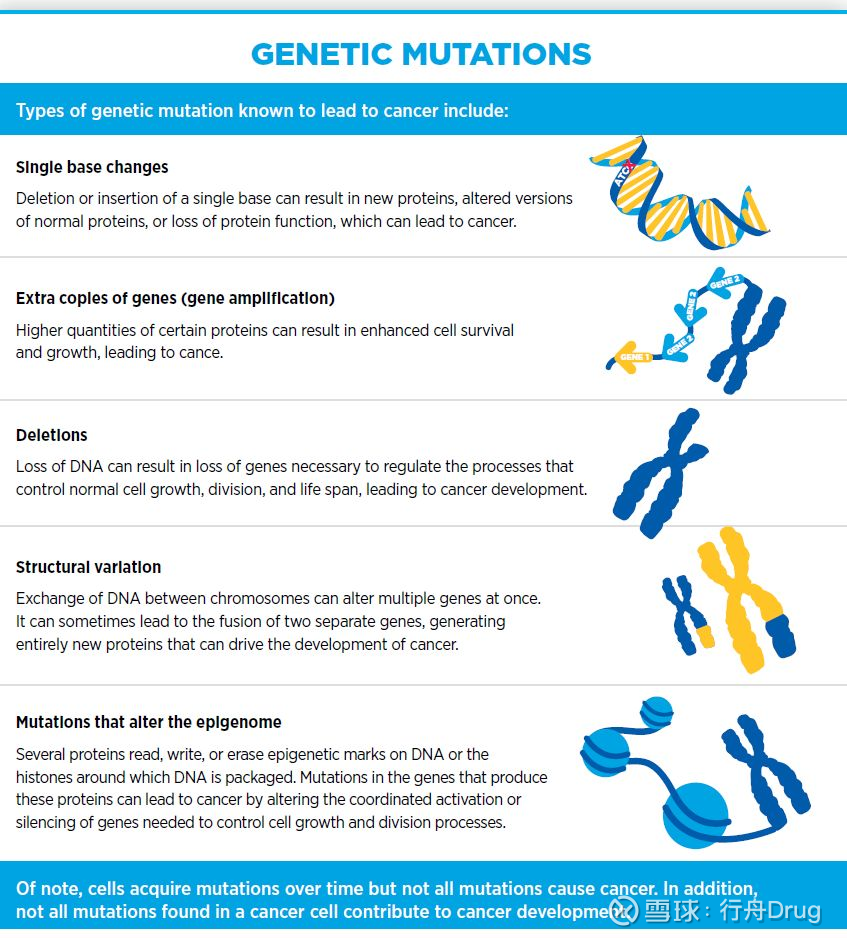
▲致癌的不同基因變異類型(圖片來源:參考資料[1])
每位患者的癌細胞攜帶的基因突變都不一樣,而且隨著腫瘤的生長,它們會獲得新的基因突變,即使同一個腫瘤中的不同癌細胞也會攜帶不同的基因突變。癌細胞攜帶的基因突變的差異性是導致癌症對療法產生耐藥性的首要原因。
對人類癌症基因組的詳盡分析已經發現了大量致癌基因突變。這些發現帶來了針對特定分子靶點的靶向療法。我們對癌症更深入的了解讓我們知道每個人的癌症都是獨特的,因此不能採用“一刀切”的方法來對他們進行治療。在過去10年裡,癌症的預防、篩查和治療正在向個體化的方向轉變。這種個體化的治療方式稱為精準醫療(precision medicine),它的目標是結合患者的基因、蛋白和環境因素等信息,制定最有針對性的預防、診斷和治療方案。

▲精準醫療圖示(圖片來源:參考資料[1])
理解致癌的風險因子讓我們更好預防癌症
在過去20年裡,美國的癌症死亡率在穩步下降,癌症倖存者(cancer survivor)的數目達到了歷史最高水平。然而,即便在2019年,仍然有40%的癌症病例和接近一半的癌症相關死亡與可以預防的風險因子相關。了解致癌的風險因子將幫助我們改變自己的生活習慣,減少患癌風險。
雖然導致癌症的風險因子很多,但是,主要的風險因子包括吸煙、肥胖、飲食習慣不良、特定病原體感染和接受紫外光輻射。
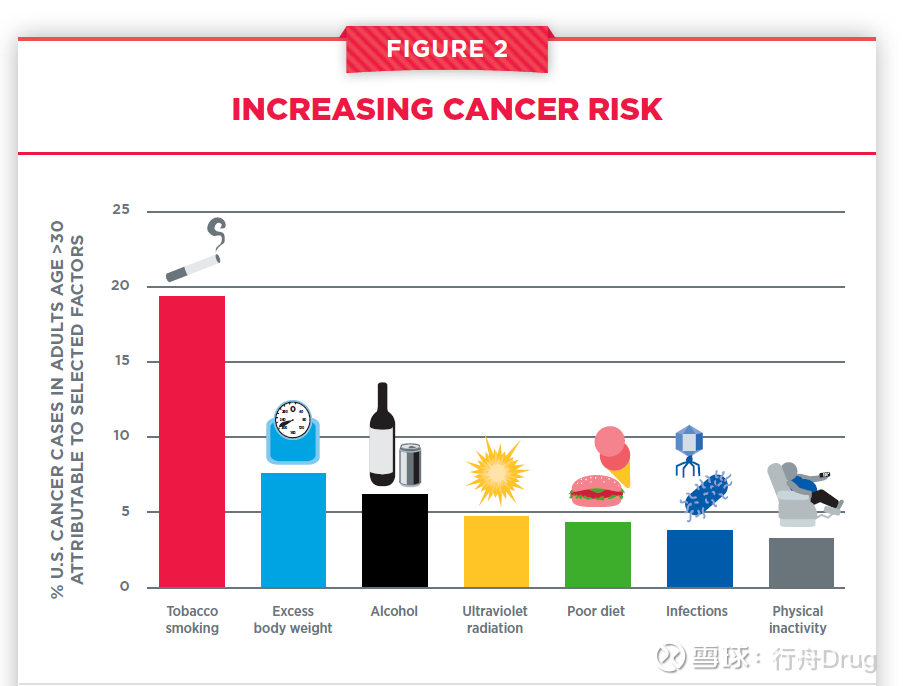
▲主要致癌的可改變風險因子(圖片來源:參考資料[1])
其中,吸煙是導致癌症的首要可以預防的因素。香煙中的多種有害化合物能夠損傷DNA,導致癌症發生的基因和表觀遺傳變異。吸煙除了增加肺癌發病風險以外,還提高其它17種癌症的發病風險。可喜的是,在任何時候戒菸都可以降低這些風險。戒菸帶來的益處從戒菸後幾週就開始出現,在戒菸10年之後,所有和吸煙相關的癌症風險能夠降低50%!
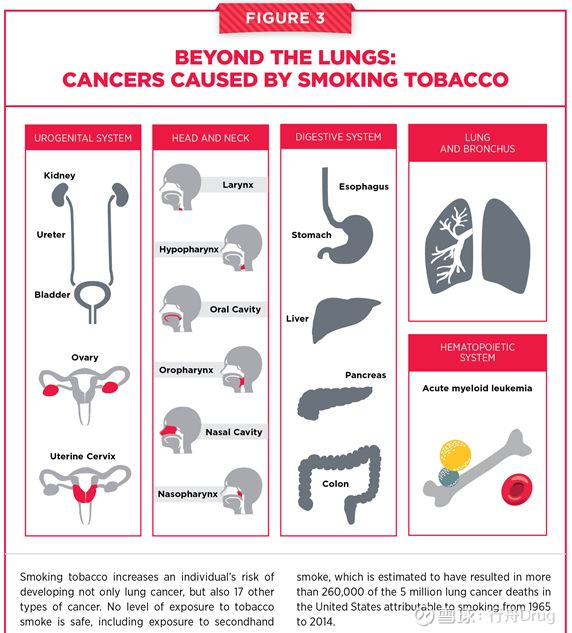
▲吸煙增加除了肺癌以外17種癌症的風險(圖片來源:參考資料[1])
除了吸煙以外維持健康體重、飲食和鍛煉習慣是預防癌症的另一個重要手段。在美國,大於20%的新癌症病例和16%的癌症死亡與肥胖、飲食習慣不良、不運動和過度飲酒相關。成人體重超重或肥胖提高15種癌症的風險,而積極鍛煉能夠降低8種癌症的風險。
創新療法改變癌症患者生活
與醫學研究相關的各個崗位上工作人員的不懈努力帶來了多款創新療法,他們不但改善了患者的生存期,還提高了他們的生活質量。從2018年8月到2019年7月,FDA總計批准了17款創新抗癌療法,而且10款已經獲批的抗癌療法在同期獲批治療新的癌症類型。
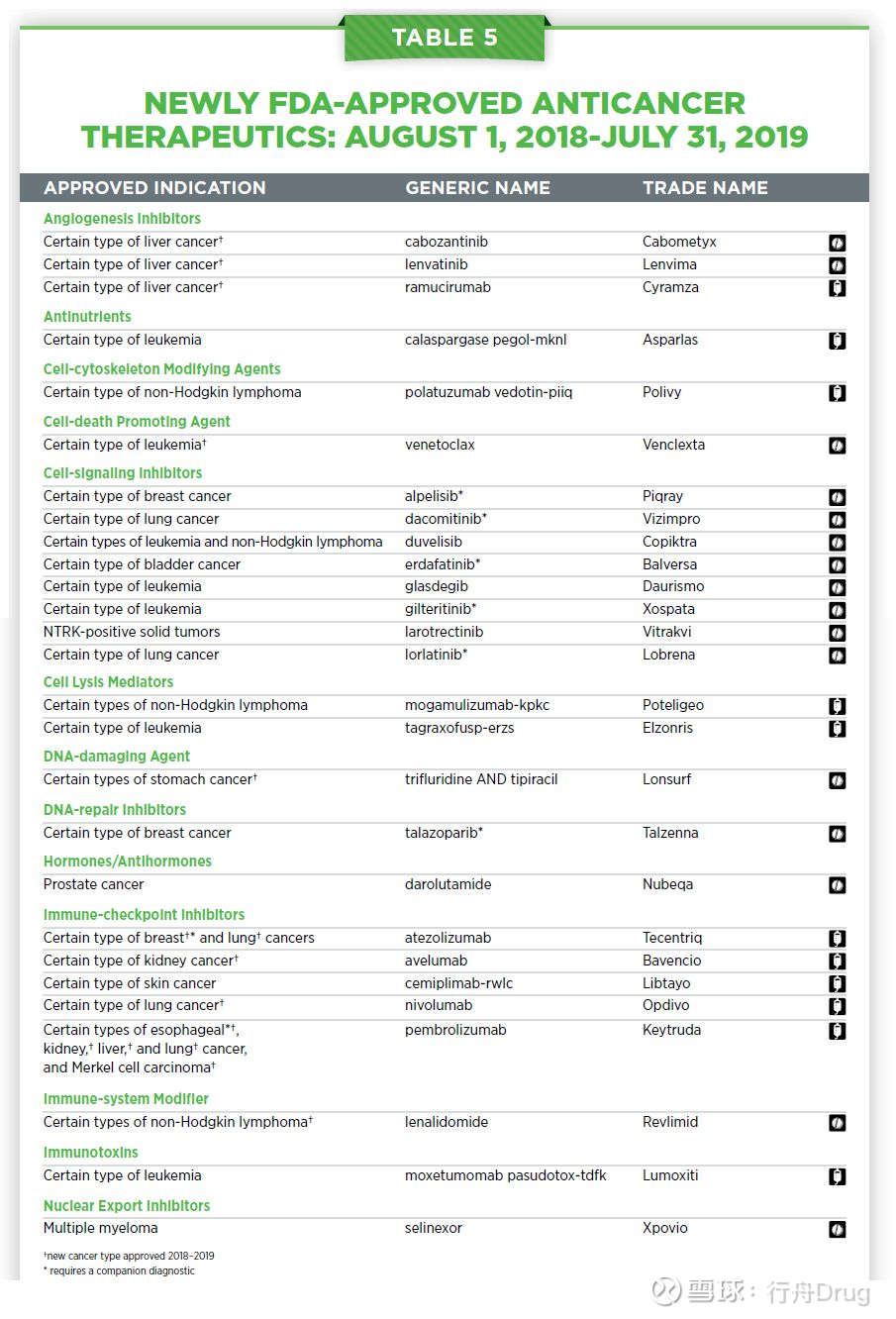
圖片來源:參考資料[1]
抗癌療法向精準醫療的轉變也可以從獲批創新療法的類型中得到驗證。從2018年8月1日到2019年7月31日,FDA批准了14款創新分子靶向抗癌療法,同時擴展四款分子靶向療法治療新的癌症類型。
其中,最重要的精準醫療進步是“不限癌種”療法Vitrakvi(larotrectinib)的獲批,它是一款治療攜帶NTRK基因融合變異的實體瘤患者的分子靶向療法。這款療法的獲批是數十年基礎和臨床研究的結晶,也是抗癌療法從基於腫瘤起源組織向基於腫瘤分子特徵轉變的重要里程碑。
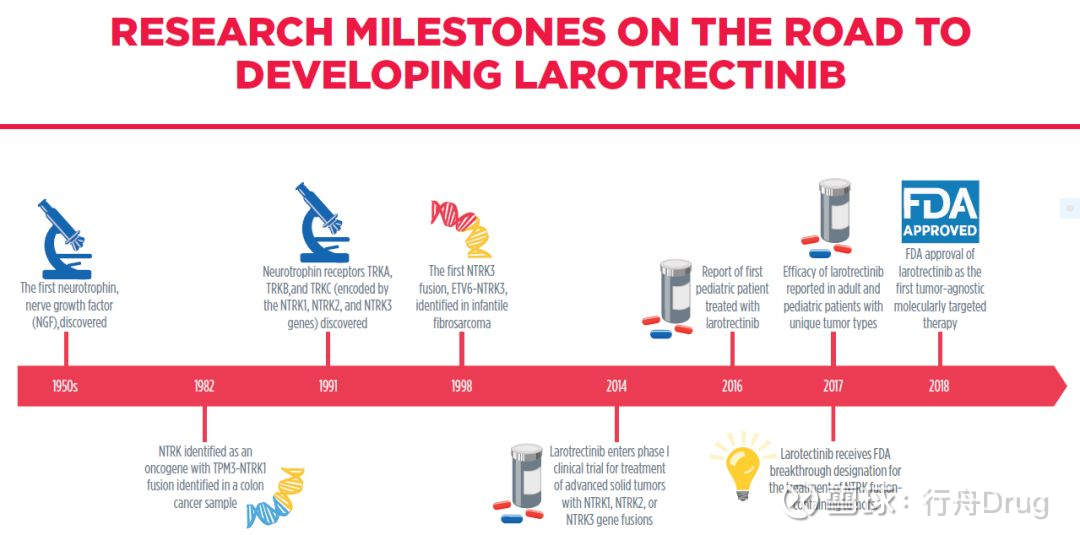
▲Larotrectinib開發過程中的里程碑(圖片來源:參考資料[1])
精準醫療在治療乳腺癌方面也得到了體現。乳腺癌仍然是美國導致女性因癌症死亡的第二大原因。而最近FDA批准了多款分子靶向療法,有望在治療這一癌症類型方面取得更多進展。其中,Alpelisib是一款阻斷PI3Kα功能的抑製劑,PI3Kα在細胞增殖和生存方面有重要作用。研究表明,PI3KCA基因上的突變,出現在40%的HR陽性,HER2陰性乳腺癌患者中。通過FDA同時批准的伴隨診斷(companion diagnostics)檢測,醫護人員可以找出攜帶這一基因突變的乳腺癌患者,為她們提供更具有針對性的創新療法。
另一款需要通過伴隨診斷篩選患者的創新療法是Talzenna(talazoparib)。這款PARP抑製劑適用於攜帶BRCA基因突變的轉移性乳腺癌患者。
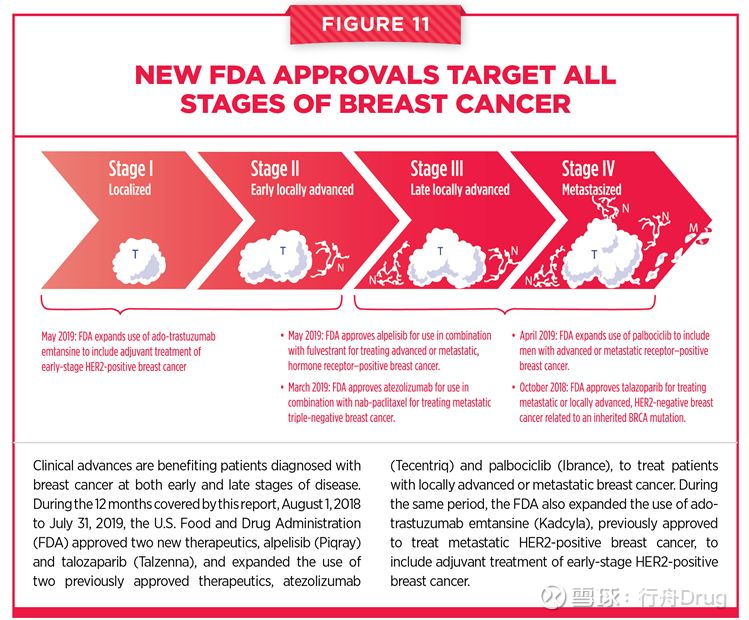
▲FDA批准的療法在乳腺癌疾病發展的各個階段改善患者的治療選擇(圖片來源:參考資料[1])
精準醫療還革新了對膀胱癌和血液癌症的治療。今年4月,FDA批准Balversa(erdafitinib)上市,治療攜帶FGFR2和FGFR3基因突變的轉移性尿路上皮癌患者。在血液學方面,FDA在報告關注的12個月裡,批准了7款分子靶向療法,其中包括靶向FLT3的Xospata(gilteritinib),用於治療攜帶FLT3基因突變的急性髓系白血病患者(AML)。
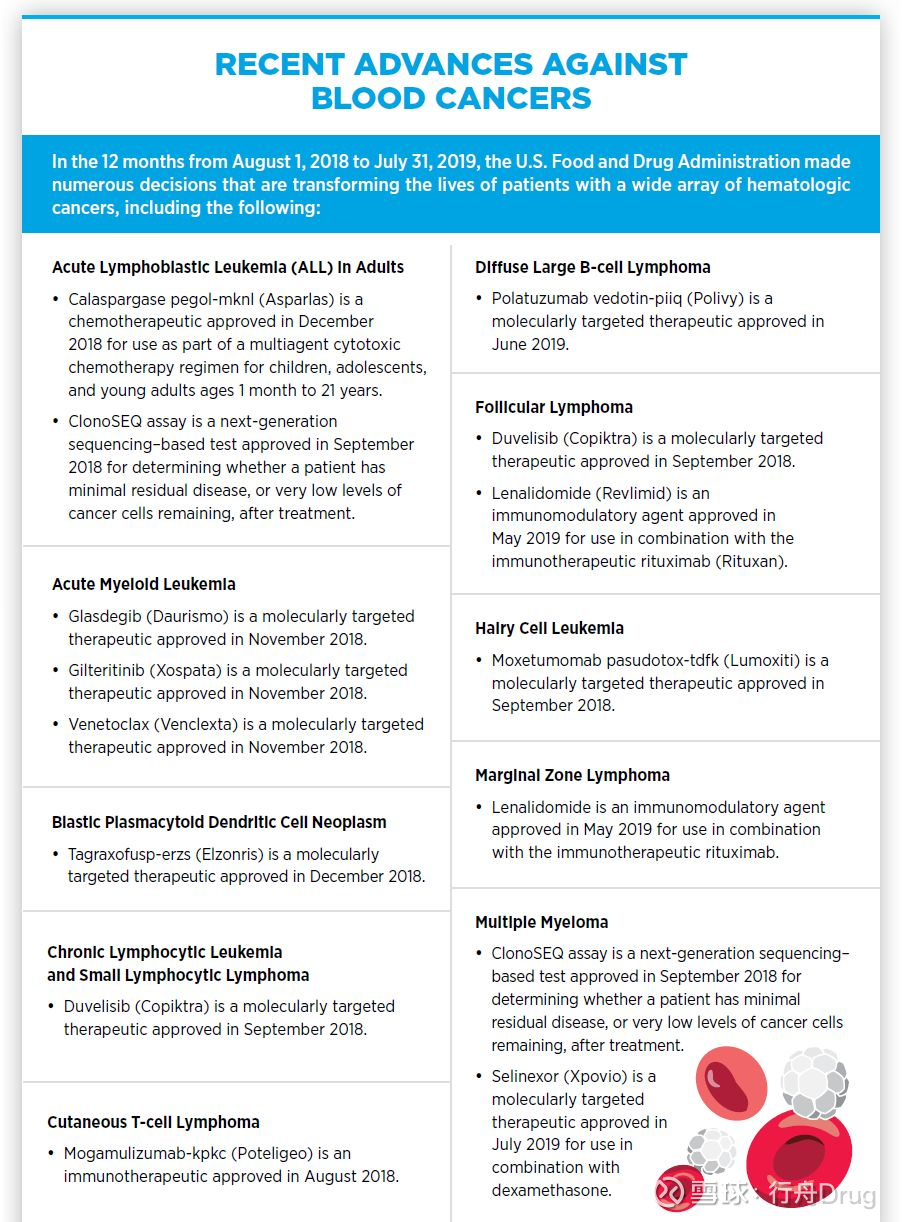
▲抗擊血液癌症的最新進展(圖片來源:參考資料[1])
除了靶向細胞內部的蛋白以外,靶向細胞外部的特定蛋白能夠提供“精準制導”的抗癌療法。在報告跟踪的12個月中,FDA批准了3款創新抗體偶聯藥物(ADC)。這些藥物通過將靶向特定蛋白的抗體和細胞毒性藥物連接在一起,讓ADC能夠靶向殺死癌細胞,而不對健康細胞產生影響。近日獲批的Polivy(polatuzumab vedotin-piiq)是一款將抗CD79b與細胞毒性藥物連接起來生成的ADC。CD79b抗原在B淋巴細胞上表達,這款ADC與其它藥物聯用,可以治療大B細胞淋巴瘤。
另外兩款ADC是靶向CD22抗原蛋白的Lumoxiti(moxetumomab pasudotox-tdfk)和靶向IL-3的Elzonris(tagraxofusp-erzs)。
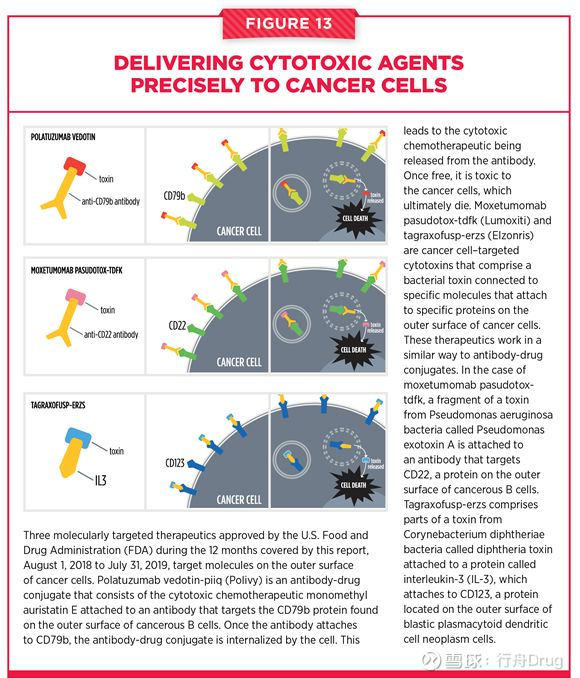
▲三款獲批的抗體偶聯藥物(圖片來源:參考資料[1])
靶向療法與手術療法、放療、細胞毒性化療和免疫療法一起,構成了癌症治療的5大支柱。癌症免疫療法是近年來湧現的治療癌症的第5大支柱。它給癌症治療帶來了革命性的轉變,為有些患者提供了顯著而持久的緩解。例如,近日發布的Keytruda長期療效結果表示,接受Keytruda治療的晚期非小細胞肺癌患者5年生存率達到23%,遠遠超過歷史上5%的水平。
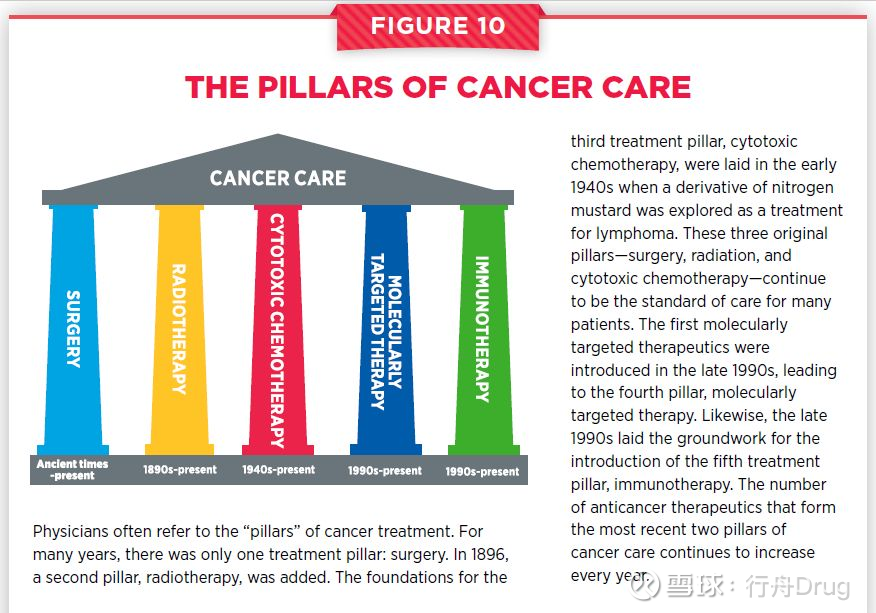
圖片來源:參考資料[1]
在免疫療法中,免疫檢查點抑製劑的發展尤為迅速。免疫檢查點抑製劑通過消除抑制免疫細胞功能的“剎車”,提高患者免疫系統消滅癌症的能力。目前,已經有7款免疫檢查點抑製劑獲得FDA批准上市,最新獲得批准的免疫檢查點抑製劑是Libtayo(cemiplimab-rwlc),用於治療皮膚鱗狀細胞癌患者。
免疫檢查點抑製劑的迅速發展還體現在它們治療的癌症種類不斷擴展。截至2019年7月31日,總計有15種癌症類型至少有一種檢查點抑製劑可以治療。Keytruda還獲得FDA批准用於治療任何微衛星不穩定性高(MSI-H)的實體瘤患者。而且有些類型的癌症患者可以從多種檢查點抑製劑中選擇治療方案。
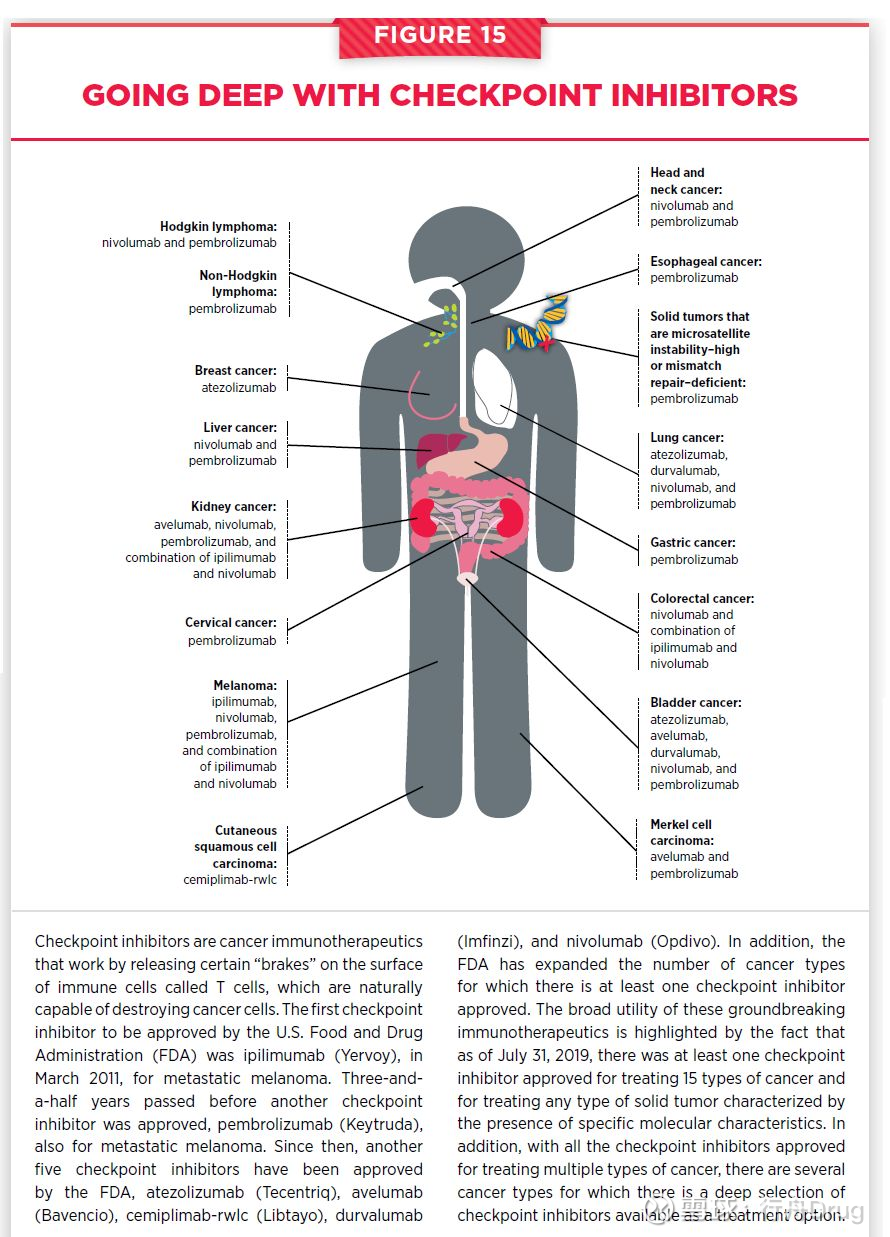
▲免疫檢查點抑製劑的廣泛應用(圖片來源:參考資料[1])
展望未來
報告表示,癌症研究處在一個令人興奮時代。近年來在癌症基因組學和免疫學研究的發現成功建立起了癌症治療的兩大支柱——靶向療法和免疫療法。它們為更多不同類型的癌症患者造福。
未來的癌症研究需要跨學科研究人員的共同協作,將應用數學、工程學、物理學等其它學科的研究與基礎醫學和臨床醫學研究結合在一起,將為癌症科學的下一個突破鋪平道路。有望進一步推動癌症科學研究的新技術包括:
單細胞技術:單細胞技術能夠讓研究人員了解腫瘤中每一種細胞的生物功能。例如,分辨腫瘤中的哪些免疫細胞起到幫助癌症增殖的功能,而哪些起到攻擊癌細胞的作用。基因編輯技術:下一代測序技術給癌症基因組學帶來了革命性變化,我們發現了跟癌症發展相關的無數基因變異。然而,確認這些基因變異是導致癌症發展的原因需要科學家們研究它們的生物學功能。基於CRISPR的基因編輯技術給研究人員提供了一種便捷的手段來改變細胞中的特定基因,並且研究基因變異的生物學後果。
改善患者護理的新技術包括液體活檢,大數據技術,人工智能,和數字健康技術等等。
最後,AACR的報告表示,科學研究是驅動抗癌進展的引擎。而對科學研究的支持和熱情將讓我們獲得前所未有的科學洞見和能力,為未來帶來癌症護理領域的更多進步。
AACR的抗癌報告長達158頁,它還對癌症早篩和患者護理等問題作出了詳盡的闡述。在藥明康德微信號回复“AACR”即可獲得下載地址,下載這篇報告全文。
參考資料:
[1] cancerprogressreport.org [Internet]. Philadelphia: American Association for Cancer Research; ©2019 [September 2019] Available from 網頁鏈接
[2] American Association for Cancer Research. Retrieved September 18, 2019, from 網頁鏈接