原文轉自奇點網
根據現行的癌症分期方法,癌症可以籠統地被分為早期、中期和晚期。
這個分類方法不僅很好的慨括了癌症的特點,而且還通俗易懂地向大眾傳遞了癌症的嚴重程度。
如果被確診的癌症是早期,腫瘤挺老實的待在原地,患者和家屬都會長吁一口氣,心裡默念“幸好發現的早”;如果確診時是晚期,那就是癌症已經擴散轉移了,醫生一般會選擇先和家屬談。
相比之下,由斯坦福大學醫學院的醫學和遺傳學助理教授Christina Curtis聯合其他4所研究機構,於近日發表在著名期刊《自然·遺傳學》上的研究[1],就有些讓人不安了。

▲ Christina Curtis本尊
(https://med.stanford.edu,Paul Sakuma攝)
他們分析了近3000名患者的基因數據,通過三維計算機模擬分析,發現高達80%的轉移性結直腸癌,可能在原始腫瘤長到罌粟種子大小(約0.01立方厘米,100萬個癌細胞,比芝麻粒還小)之前,就擴散到體內的其他地方了。而這個大小,目前在臨床上是檢測不到的。來自中國的三位青年才俊Hu Zheng,Ding Jie和Ma Zhicheng是論文的前三位作者。
“這一發現非常令人驚訝,”Christina Curtis博士說[2]。“這表明癌症在誕生之初就獲得了轉移能力。顯然,我們的結論與轉移發生在癌症晚期這個流行假設相反,會對患者分期、治療和早期檢測產生一定的影響

▲三位中國青年才俊(左→右對應上一段的名字)
不過癌症轉移的時間,以及決定癌細胞轉移的關鍵分子機制在很大程度上還不清楚 [3,4]。而這兩點對於癌症的臨床診斷和治療,有重要價值。
進入21世紀,我們都認為癌症是一種基因病,癌細胞的產生和轉移,是體細胞逐漸積累基因突變導致的,因此主流觀點認為,當腫瘤發展到一定程度之後,會有一部分細胞獲得轉移的能力 [5,6]。
然而,近年來,已經有研究人員在早期乳腺腫瘤患者體內發現擴散出去的腫瘤細胞[7],在早期乳腺癌[8]和胰腺癌[9]的小鼠模型中,研究人員也發現了播散出去的腫瘤細胞。
▲ Christina Curtis實驗室的主頁,非常有科技感
這就讓一些研究人員對主流觀點產生了質疑。還有一些科學家被這些新發現吸引,他們想知道,如果癌細胞能在腫瘤形成的早期就開始擴散,那麼究竟有多早呢?觸發的機制又是什麼呢?
同時在大量患者身上獲取兩處腫瘤組織有一定的難度,因此,目前還沒有研究能評估人類癌症的轉移時間。
因此,尋找合適且足夠的研究材料,成為這個問題的關鍵突破口。
▲腸癌(mskcc.org)
Christina Curtis博士團隊將寶壓在了腸癌上。
腸癌發病率和死亡率都比較高[10],且研究的比較多,因此腸癌的驅動基因與疾病發展之間的關係也相對比較清楚 [5]。而且腸癌的主要轉移對象肝臟[11],和罕見轉移對像大腦[12],也能通過切除獲取轉移灶腫瘤組織。
雖然目前腸癌轉移的主流模型也是腫瘤經過一系列的克隆進化之後,到晚期才轉移[5]。但是也有數據證明,腸癌也是“天生的壞種”,在腫瘤誕生的早期就具備了轉移的能力 [13]。
如此看來,腸癌確實是個合適的模型。
▲腸道(該圖片由LJNovaScotia在Pixabay上發布)
研究人員在多個研究隊列中,找到23例存在肝轉移或者腦轉移的腸癌患者。其中10例腦轉移患者有72份組織活檢樣本,13例肝轉移患者有46份組織活檢樣本。研究人員給這118個組織樣本做了全外顯子基因組測序分析,以便從中發現腸癌轉移的路徑和時間。
研究人員將原發灶與轉移灶的基因突變做了個比對,發現原發灶和轉移灶的癌症驅動基因之間保持了高度的一致性。KRAS,TP53,SMAD4等的突變在原發性和轉移性腫瘤也是一致的。此外,這兩處的腫瘤也可能共享SNV和小插入缺失。
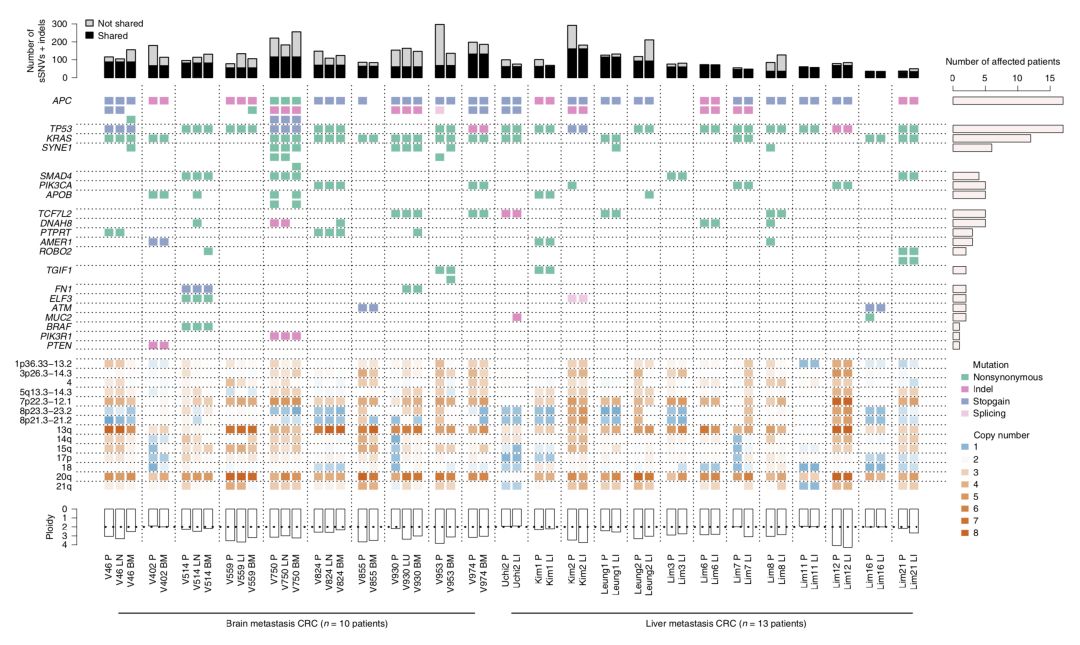
▲ 原發灶和轉移灶基因變異情況幾乎一樣啊
(豎虛線之間是一位患者的數據原發灶或者兩個轉移灶)
給每位患者的腫瘤發展歷程做了個進化樹
在可以分析的21名患者中,有17名患者的轉移灶是從一小撮癌細胞,甚至是一個癌細胞發育而來,而且從整個進化樹來看,這些形成轉移灶的細胞形成於腫瘤發展的早期。這就暗示,在腸癌誕生的初期,這些形成轉移灶的癌細胞就離家出走了。
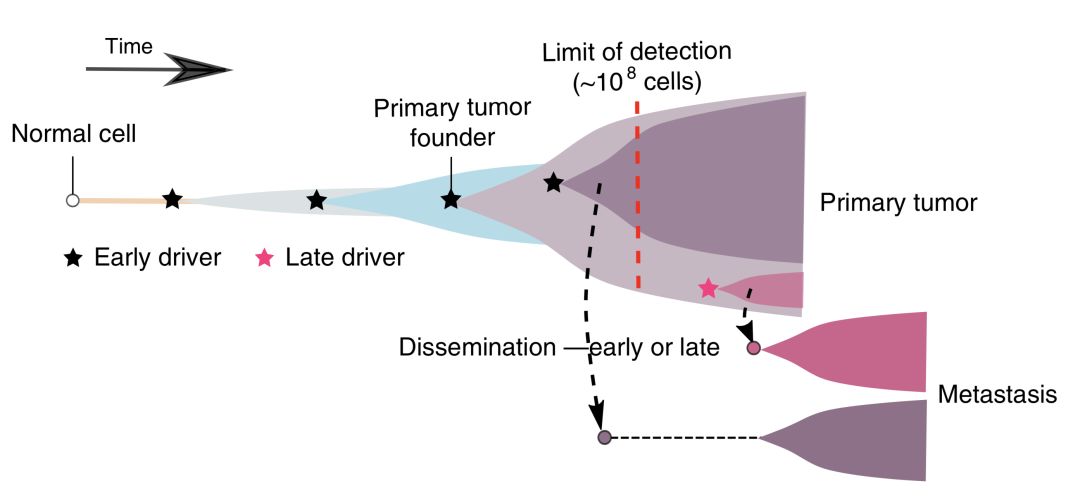
▲腸癌發家史
那這個早期到底是多早呢?
對於這個問題,目前這個進化樹模型是難以回答的。不過這也難不倒在計算生物學方面受過專業訓練的Christina Curtis博士。
她帶領團隊開發了一個三維計算模型[13],這個模型可以模擬在不同的參數條件下腫瘤的大小,及其與疾病進展和基因變異之間的關係。
有了這個模型,他們很快就算出了21名患者癌細胞轉移時的腫瘤大小。結果,那17名(83%)早期轉移的患者,轉移的真是非常早啊。在腸道腫瘤體積不足0.01立方厘米,也就是不到100萬個細胞的時候,一部分癌細胞就已經離家出走了。
甚至有4名患者,在腫瘤只有1萬個細胞,體積只有0.0001立方厘米的時候,就轉移了。。。這也太早了吧~
從理論上講,體積小於0.01立方厘米的腫瘤,在臨床上是檢測不到的。這就意味著,對於那17位患者而言,幾乎是腫瘤一誕生,就是晚期。這些癌細胞那真是配得上“天生的壞種”這個稱呼。
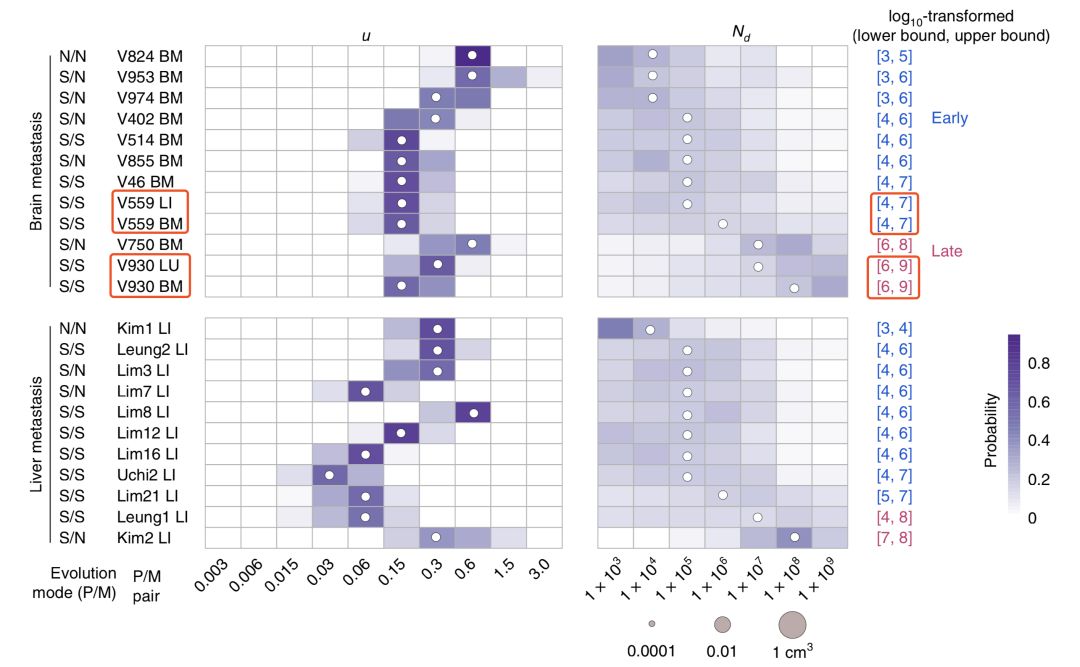
▲轉移時腫瘤的大小,紅框內是同一患者的兩組數據
可以看到腫瘤體積為0.0001立方厘米、10000個細胞時,發生轉移的4位患者
那這些“天生的壞種”有沒有什麼特點呢?
研究人員又調用了MSK-Impact[14]和GENIE[15]研究中2751名腸癌患者的測序數據。這2751名患者診斷結果明確,有938名患者為IV期轉移性腸癌患者,另外的1813名患者為I-III期的早期腸癌患者;此外,這些患者的基因變異數據也比較完整。
將這些數據與上面的結果相結合,研究人員有了不小的發現。
“我們發現特定的突變組合可以預測轉移,”Christina Curtis博士說。例如,一個名為PTPRT的基因突變與經典結直腸癌驅動基因的突變相結合,幾乎只在轉移性癌症患者中出現。
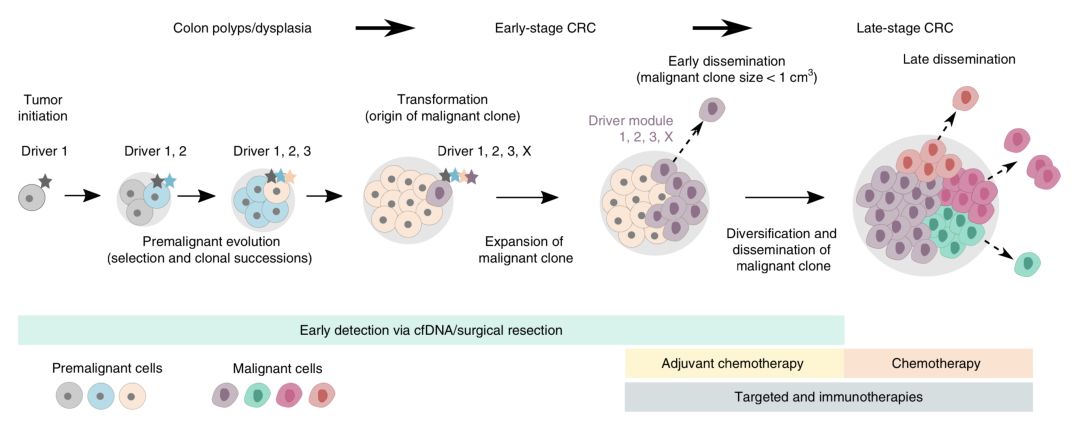
▲ 腸癌的進化轉移史
PTPRT功能的喪失會增加一個名為STAT3蛋白的活性,從而增強了細胞的存活能力 [16],因此STAT3有可能是個不錯的抗癌靶點。
此外,PTPRT的基因突變或許還可以用於指導患者的治療。如果切下的早期腫瘤中發現這個基因變異,或許可以考慮全身輔助化療。當然,這個還需要臨床研究去驗證。
總的來說,Christina Curtis博士團隊的這個研究表明,腸癌的轉移可以發生在腫瘤形成的初期。現在看來,人類迫切需要一種能檢測這些難以發現惡性腫瘤的方法。希望研究液體活檢的科學家們繼續努力。
參考資料:
[1].Zheng Hu, Jie Ding, Zhicheng Ma, et al. Quantitative evidence for early metastatic seeding in colorectal cancer[J]. Nature Genetics, 2019.
[2].https://med.stanford.edu/news/all-news/2019/06/most-metastatic-colorectal-cancers-have-spread-before-diagnosis.html
[3].Turajlic S, Swanton C. Metastasis as an evolutionary process[J]. Science, 2016, 352(6282): 169-175.
[4].Lambert AW, Pattabiraman DR, Weinberg RA, et al. Emerging biological principles of metastasis[J]. Cell, 2017, 168(4): 670-691.
[5].Jones S, Chen WD, Parmigiani G, et al. Comparative lesion sequencing provides insights into tumor evolution[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(11): 4283 -4288.
[6].Campbell PJ, Yachida S, Mudie L, et al. The patterns and dynamics of genomic instability in metastatic pancreatic cancer[J]. Nature, 2010, 467(7319): 1109-1113.
[7].Sanger N, Effenberger KE, Riethdorf S, et al. Disseminated tumor cells in the bone marrow of patients with ductal carcinoma in situ[J]. International Journal of Cancer, 2011, 129(10): 2522-2526.
[8].Hosseini H, Obradovic MM, Hoffmann M, et al. Early dissemination seeds metastasis in breast cancer[J]. Nature, 2016, 540(7634): 552-558.
[9].Rhim AD, Mirek ET, Aiello NM, et al. EMT and Dissemination Precede Pancreatic Tumor Formation[J]. Cell, 2012, 148(1): 349-361.
[10].Siegel RL, Miller KD, Fedewa SA, et al. Colorectal cancer statistics, 2017.[J]. CA: A Cancer Journal for Clinicians, 2017, 67(3): 177-193.
[11].Vatandoust S, Price TJ, Karapetis CS, et al. Colorectal cancer: Metastases to a single organ.[J]. World Journal of Gastroenterology, 2015, 21(41): 11767-11776.
[12].Christensen TD, Spindler KG, Palshof JA, et al. Systematic review: brain metastases from colorectal cancer—Incidence and patient characteristics[J]. BMC Cancer, 2016, 16(1): 260-260.
[13].Sottoriva A, Kang H, Ma Z, et al. A Big Bang model of human colorectal tumor growth[J]. Nature Genetics, 2015, 47(3): 209-216.
[14].Yaeger R, Chatila WK, Lipsyc M, et al. Clinical Sequencing Defines the Genomic Landscape of Metastatic Colorectal Cancer[J]. Cancer Cell, 2018, 33(1).
[15].AACR Project GENIE Consortium. AACR Project GENIE: powering precision medicine through an international consortium[J]. Cancer discovery, 2017, 7(8): 818-831.
[16].Zhang X, Guo A, Yu J, et al. Identification of STAT3 as a substrate of receptor protein tyrosine phosphatase T[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104( 10): 4060-4064.




