




來源:奇點網
阿司匹林的防癌技能,終於又迎來重磅臨床證據。
昨天,頂級醫學期刊《柳葉刀》發表了英國紐卡斯爾大學John Burn教授團隊的重要研究成果:攜帶遺傳性突變的腸癌高危人群,連續服用2年以上阿司匹林,能把腸癌的發病率降低50 %;更厲害的是,阿司匹林的這種保護作用竟然能持續長達20年之久。
▲ 論文首頁截圖
說起阿司匹林防癌,大家千萬不要以為是近年來才興起的熱門研究方向。
實際上,早在1988年,科學家就在病例對照研究中觀察到了阿司匹林的防癌潛力[2]。從那以後就一發不可收拾。據不完全統計,有100多個觀察性研究發現了阿司匹林的防癌作用[3,4]。
近年來,這個研究課題尤其火爆,有很多回顧性研究發現,阿司匹林的使用與癌症的發病率降低有關;還有很多基礎研究發現了阿司匹林抗癌、防癌的分子機制。不過,也有很多研究發現二者之間沒有關係。(想了解過往相關研究的朋友,回頭可以看下文章開頭的“阿司匹林專輯”)
“我在30年前就有一個想法:那些有結直腸癌遺傳傾向的人,可以幫助我們了解阿司匹林是否真的可以降低癌症風險。”John Burn教授說[5]。
因此Burn教授決定把林奇綜合徵患者作為研究對象。林奇綜合徵又被稱為遺傳性非息肉病性結直腸癌,這些患者會攜帶MLH1、MSH2、MSH6、PMS2或EPCAM等基因的致病性突變,這些突變會導致DNA錯配修復缺陷。
從目前的數據來看,林奇綜合徵導致的腸癌佔全部腸癌的3%左右。這一比例雖然低,但是80%左右的林奇綜合徵患者最終會患上結直腸癌。除了腸癌之外,林奇綜合徵還與子宮內膜癌等多個部位的癌症高發有關。
u▲ John Burn教授
經過數年的籌備,1999年,在英國癌症研究所和歐盟等多個組織和機構的支持下,Burn教授領銜的研究團隊啟動了CAPP2(癌症預防計劃)研究。
這個研究於1999年1月到2005年3月之間,在全球範圍內的43個臨床研究中心招募了1071名林奇綜合徵患者,其中937人符合入組條件。
最終有861名患者願意參加這個臨床研究,平均年齡42歲。將所有患者隨機分成兩組,其中一組427人,每天吃600mg阿司匹林,持續2年或者4年(患者自行決定);另一組434人,每天服用安慰劑。
研究的主要終點是阿司匹林干預2年之後,發現的結直腸癌的數量、大小和組織學階段;次要終點是腺瘤和其他林奇綜合徵相關腫瘤的大小和數量。
▲ 研究流程圖
2008年的時候,在所有的患者都完成阿司匹林干預之後,研究人員分析了一次數據,發現阿司匹林沒有預防效果[6]。不過之前有研究發現,阿司匹林的保護作用顯現的比較晚,因此研究人員決定延長隨訪時間。
到2011年,第一個接受阿司匹林干預的患者隨訪時間到10年,平均隨訪時間達到4年零7個月的時候,研究人員又分析了一次數據[7]:意向治療分析顯示,與安慰劑相比,阿司匹林對結直腸癌的預防作用依舊不顯著。不過,當研究人員只分析那些干預時間超過2年的患者時,終於觀察到了阿司匹林的保護作用。
距離第二次數據分析9年之後,研究人員又一次分析了CAPP2研究的數據。這一次,所有的患者隨訪時間都超過10年,英國、芬蘭和威爾士的參與者隨訪時間甚至長達20年。
總的來看,阿司匹林干預組有74人被確診為癌症,發病率為17%;安慰劑對照組有89人確診,發病率為21%。意向治療分析兩組差異不顯著,如果只分析服藥超過2年以上的患者,阿司匹林組風險降低37%,差異顯著。兩組的不良事件和依從性相似。
▲ 兩組患者不同亞組的數據對比
具體到腸癌而言,阿司匹林干預組有40人被確診為腸癌,發病率為9%;安慰劑對照組有58人確診,發病率為13%。意向治療分析顯示,與安慰劑對照組相比,阿司匹林干預組患腸癌的風險降低35%,兩組差異顯著。如果只分析服藥超過2年以上的患者,風險降低44%,發病率直接減半。
在單獨分析阿司匹林對其他癌症的預防作用的時候,研究人員沒有發現顯著的差異。
▲ 阿司匹林在不同腫瘤類型,不同干預時間群體中的效果
基於以上研究結果,哈佛醫學院的Andrew Chan和Matthew Yurgelun總結了以下幾點[8]:
第一,林奇綜合徵患者每天口服600mg阿司匹林可大幅降低患腸癌的風險;
第二,阿司匹林的保護效果,在5年之後才顯現出來,早期觀察不到;
第三,阿司匹林的保護效果持久,可持續20年的時間;
第四,阿司匹林似乎也對子宮內膜癌有預防作用,阿司匹林組7例患者,對照組17例患者,雖然不具有統計學意義,但是值得進一步研究。
實際上,近年來已經有很多指南建議林奇綜合徵患者考慮使用阿司匹林[9,10],這項研究成果再次強化了上述推薦。
儘管如此,研究人員認為,對於林奇綜合徵群體而言,阿司匹林的最優劑量和服用時間仍需要進一步研究。因為CAPP2研究入組的患者比較年輕,之前的ASPREE研究發現,阿司匹林在65歲以上的老年人群體中的效果和副作用,與年輕人差異較大[11]。
不過,無論如何,這個研究可能表明,對於林奇綜合徵群體而言,40歲左右的年紀,可能是最佳的干預時間。
Burn教授表示,他和他的團隊正在開展CAPP3研究,這個研究會招募1882名林奇綜合徵患者,以探討更小、更安全的阿司匹林劑量是否有一樣的防癌效果。
…

結直腸癌是男性和女性的第三大常見癌症。明智的食物選擇可以幫助你減少患病的機會。一些研究表明,飲食健康、鍛煉身體、保持健康體重、將酒精攝入量控制在低限度的人,患結直腸癌的機率會降低三分之一以上。下面是從飲食上預防結直腸癌的8點建議:
01食用乳製品大多數研究都認為,富含鈣的乳製品可以降低患結腸癌(稱為腺瘤)和結直腸癌的可能性。補鈣也有幫助。問問你的醫生什麼可能適合你。
此外,維生素D(添加到牛奶中)可能也可以預防這類癌症,但還需要更多的研究。
02食用全穀物全穀物富含營養,是鎂和纖維的良好來源。它們會讓你的糞便蠕動,同時,它們可能會抓住你結腸裡的致癌化合物。
每天攝入90克全穀物——燕麥片、全麥麵包和糙米都是不錯的選擇。
03食用豆類這些豆類和其他豆科植物(例如大豆、豌豆和扁豆)富含纖維、蛋白質、維生素B和維生素E。它們還含有一種叫做類黃酮的化合物,可以防止腫瘤生長,以及某些可能有助於預防結腸癌的抗氧化劑。
試著用黑豆代替平常的配菜,或者做一碗豐盛的湯。
04食用顏色豐富的果蔬顏色豐富的果蔬含有天然物質(植物化學物質),可以阻止癌細胞的生長或對抗可能引發癌症的炎症。將水果和蔬菜與預防結腸癌聯繫起來的研究結果並不一致,但癌症機構建議將它們作為健康飲食的一部分。
理想的選擇是西蘭花、捲心菜,和富含維生素C的水果,比如橙子。
05食用魚肉富含脂肪的魚類,如鮭魚,富含omega-3脂肪酸,這對心臟健康很有好處,還可能減緩癌細胞的生長。但吃魚是否能幫助預防結直腸癌還不清楚。一些研究確實發現,吃魚而不是紅肉的人,患直腸癌的可能性更低。
但是要限制箭魚、金槍魚、方頭魚、鯊魚和鯖魚。他們可能含有汞和其他污染物,隨著時間的推移會損害你的健康。
06限制食用紅肉剛出爐的多汁漢堡可能會吸引你的味蕾,但對你的結腸卻是個壞消息。科學家們知道,經常吃紅肉,比如牛肉、豬肉和羊肉,會讓你更容易得結腸直腸癌。但他們不知道為什麼。這可能是因為肉本身,也可能是在高溫下烹飪時形成的致癌物質。
建議每週食用紅肉要少於18盎司(0.5千克)。
07限制食用加工肉類這些肉類是經過煙熏、醃製或添加化學物質醃製而成的。食用這些肉類(熱狗、培根、火腿、臘腸和包裝午餐肉等),通常會增加你患結腸癌和胃癌的機率。
08限制飲酒偶爾喝上一杯,似乎不會影響你患結腸癌的機率。但是,中度至過量飲酒(每天2-3杯),會使你患病的機率增加20%,而過量飲酒則會使你患病的機率增加40%。
如果你經常一天喝三杯以上,就需要和你的醫生談談結直腸癌的篩查了。
其他我們不知道以下這些常見的食物和飲料,是否會導致或預防結直腸癌:咖啡、茶、含咖啡因的飲料、含糖食物、土豆和大蒜等。
研究人員正在繼續研究飲食和結腸直腸癌之間的聯繫,所以未來可能會出來更多的飲食預防建議。
來源:
本文編譯自WebMD網站發布的《Best and Worst Foods to PreventColorectal Cancer》,原文鏈接:
https://www.webmd.com/colorectal-cancer/ss/slideshow-foods-prevent

真不知道人體還有多少神奇的秘密等著科學家去發現。
前不久,美國紐約大學醫學院微生物學家Ken H. Cadwell和Victor J. Torres領銜的研究團隊,在頂級期刊《自然》上發表的重磅研究成果[1],再一次刷新了我對人體先天性免疫的認知。
他們發現,人體細胞在發現超級耐藥菌的DNA之後,竟然會把細胞膜表面能被細菌毒素結合的蛋白以外泌體的形式分泌出去。如此以來,超級細菌釋放的殺傷性毒素就被外泌體誘捕了,讓細胞躲過一劫。
不得不說,咱們人體細胞這招“壁虎斷尾”的手段,實在是高明極了。
研究人員認為,他們可能發現了一種對抗細菌感染的全新先天性免疫機制 [2]。
▲ 細菌與細胞之間的攻防大戰:黃色是外泌體,紫色是毒素,藍色是細菌
耐甲氧西林金黃色葡萄球菌(MRSA)是一種常見的超級細菌,對很多抗生素產生了耐藥性。它能通過分泌孔道形成毒素(PFTs)破壞宿主的細胞膜,導致宿主細胞死亡 [3]。
不過研究人員觀察到一個現象,在美國大約有五分之一的人身上有MRSA,但是死於MRSA感染的人極少,大約在萬分之一左右[4]。
這促使Cadwell和Torres思考一個問題:在人體內是不是也存在一種可以中和孔道形成毒素的先天性免疫機制呢?
▲ Victor J. Torres(圖源:med.nyu.edu)
基於之前的研究,Cadwell和Torres已經知道,細菌分泌的孔道形成毒素會與細胞表面的金屬蛋白酶ADAM10結合,導致細胞膜穿孔 [5]。而在五年前,Cadwell和Torres已經聯手發現細胞的自噬蛋白ATG16L1能保護細胞免遭MRSA孔道形成毒素(α-毒素)的傷害 [6]。
那麼自噬蛋白ATG16L1、金屬蛋白酶ADAM10和孔道形成毒素之間究竟是什麼關係呢?背後會不會隱藏著一種鮮為人知的先天免疫機制呢?
要搞清楚上面的兩個問題,就得先在細胞內理清ATG16L1和ADAM10之間的關係。
▲ Ken H. Cadwell(圖源:med. nyu. edu )
Cadwell和Torres團隊首先在人肺泡上皮細胞系中抑制ATG16L1基因的表達,結果ADAM10的表達水平升高了。用純化的α-毒素處理ATG16L1基因表達水平低的細胞,導致細胞大量死亡;而ADAM10基因表達被抑制的細胞,則對α-毒素有抗性。
這個結果表明,α-毒素受體ADAM10的表達水平是受ATG16L1負調控的。簡單地講,ATG16L1通過降低細胞表面ADAM10的數量,讓細胞對MRSA分泌的α-毒素有了抗性。
那這個過程是如何發生的呢?
由於ATG16L1是個自噬蛋白,研究人員首先想到的自噬,即ATG16L1調集自噬通路,把ADAM10降解了。不過,Cadwell和他的同事卻發現,ATG16L1降低ADAM10的水平,與自噬沒有一丁點兒關係。
▲ ATG16L1和ADAM10的表達狀況與毒素處理下細胞的死亡率
繼續查閱相關資料之後,Cadwell團隊發現,ATG類蛋白還可以促進細胞釋放外泌體 [7]。巧的是,ADAM10竟然會出現在直徑為40nm-120nm的外泌體上 [8]。
難道說ATG16L1讓細胞把α-毒素的受體ADAM10裝在外泌體表面釋放掉了?
Cadwell和他的同事迅速掉頭分析了ATG16L1表達被抑制的細胞和正常細胞分泌的外泌體的情況。
果不其然,ATG16L1表達降低之後,攜帶ADAM10的外泌體大幅減少了。而且他們還證實,ATG16L1是通過調節外泌體的形成達到降低細胞表面ADAM10的目的,而不是對ADAM10本身發生作用。
到這裡,前面提出的第一個問題基本就算說清楚了:ATG16L1通過促進外泌體的形成,降低細胞表面的ADAM10,避免細胞被α-毒素破壞。
▲ ATG16L1表達水平降低,外泌體肉眼可見地減少
那麼細胞的這一過程究竟是不是受細菌感染的調控呢?
為了解決這個問題,Cadwell團隊用高溫殺死多種細菌,然後再用這些細菌刺激人和小鼠的細胞,結果外泌體的分泌都顯著增加了。在分別測試了細菌身上的多種物質之後,他們確定是細菌的DNA誘發了外泌體的大量分泌。
小鼠的實驗也證實,如果抑制ATG16L1的表達,用細菌處理也不能促進外泌體的產生。
▲ 不同的細菌處理後,外泌體的釋放都增加了
那麼細胞在感應到細菌的存在之後,釋放的外泌體究竟有沒有防禦功能呢?
研究人員分別從ATG16L1低表達和正常表達的細胞系中分離外泌體,然後用這些外泌體和α-毒素一起處理肺泡上皮細胞。結果如研究人員所料,ATG16L1正常表達的細胞產生的外泌體,對肺泡上皮細胞有保護作用,而ATG16L1低表達的細胞外泌體則沒有保護作用。
不過當加入更多ATG16L1低表達的細胞外泌體之後,這種保護作用也逐漸顯現。這再次表明,保護作用是由外泌體數量決定的。隨後的小鼠體內實驗也再次證實了上述過程。
除此之外,研究人員還發現,不同的細胞類型分泌的外泌體攜帶有不同類型的毒素受體,這也意味著不同細胞分泌的外泌體,或許可以誘捕併中和不同的細菌毒素。
▲ 吹泡泡消滅細菌(圖源:見水印)
基於以上研究,Cadwell團隊認為,他們的研究表明,細胞分泌外泌體可能是一種防禦細菌感染的全新先天性免疫反應。它通過釋放攜帶毒素結合蛋白的外泌體,誘捕細菌釋放的各種毒素,防止人體細胞或組織被細菌傷害。
Torres認為,這項研究結果不僅讓我們對哺乳動物防禦感染有了全新的認知,而且還提出了一個加強免疫系統的新策略—— 可以通過向體內註入人工的外泌體來吸收細菌毒素,或者通過促進外泌體的產生來增強人體的防禦能力 [4]。
奇點糕認為,科學真的很迷人。
編輯神叨叨
[1].Keller MD, Ching KL, Liang FX, et al. Decoy exosomes provide protection against bacterial toxins[J]. Nature, 2020, 579(7798): 260-264.
[2].Du Toit A. Distracting your enemy with bubbles[J]. Nature Reviews Microbiology, 2020, 18(5): 263-263.
[3].Dal Peraro M,…

文|楊志英菠蘿
近年來,體檢中被查出肝臟血管瘤的人越來越多。看到報告中出現了“瘤”這個字,很多人感到緊張害怕,擔心自己生了非常嚴重的疾病,其實這是一個認識的誤區。
肝臟血管瘤不是惡性癌症,而是肝臟裡最常見的良性腫瘤。肝臟血管瘤的患者非常多,據文獻報導,5-7%的人群都有。
大家感覺身邊查出肝臟血管瘤的人越來越多,一個重要原因是體檢的普及率越來越高,儀器越來越靈敏,因此找出了很多無症狀的小血管瘤,其特點是臨床無症狀,病程長,生長慢,症狀輕。對於這類小腫瘤,通常並不需要激進治療,而是推薦定期復查。
事實上,只有很少的一部分的肝臟血管瘤需要治療,絕大多數肝臟血管瘤對健康並沒有影響。具體哪些情況需要處理呢?我們一起來看看關於肝臟血管瘤的那些事兒。
什麼是肝臟血管瘤?
肝臟血管瘤是肝臟最常見的良性腫瘤,在任何年齡段均可發病,以30-50歲多見,女性多於男性。尤其是直徑>5cm的肝血管瘤中,女性發病率顯著高於男性。這很可能和雌激素能促進血管瘤發展有關係。
但大部分肝臟血管瘤體積較小,患者無任何症狀,偶然在體檢時發現。年齡與發病率有一定的關係,隨著年齡的增大,發病率有所增加,到40-60歲時達高峰,隨後有所下降。
血管瘤的生長速度也與年齡相關,30-40歲為血管瘤生長速度的最高峰,50歲以後血管瘤生長速度減慢,到了60歲以上,有的甚至會自動消退。
肝臟血管瘤怎麼確診?
目前超聲是常用的體檢手段,患者的肝臟血管瘤多是由超聲檢查發現的。但普通超聲檢查有一定的局限性,有時難以明確病灶性質是否為血管瘤,仍需進一步檢查增強的影像學檢查,如:增強CT、增強核磁或是造影超聲。
經過增強影像學檢查確認為肝臟血管瘤後,可以定期通過超聲檢查,觀察病灶的大小變化即可,而不用每次復查都做增強影像。
肝臟血管瘤需要治療麼?怎麼治療最好?
肝臟血管瘤是否需要治療與其體積大小和臨床症狀有關,絕大多數肝臟血管瘤體積小且不引起任何症狀,因此不需要治療。
一般5cm以下的肝臟血管瘤很少引起症狀,5-10cm的肝臟血管瘤,不同位置可能產生的症狀不一樣,需視具體情況決定是否需要治療,而直徑在10cm以上的血管瘤,大多數均需要治療。
血管瘤治療的重點在於緩解症狀,以及控制巨大或者多發性的瘤體破裂出血可能,同時還要充分考慮到不同治療帶來的風險。對有爭議的,包括無臨床症狀的患者,切勿過度治療,帶來不必要的並發症和副作用。
肝臟血管瘤應該怎麼治呢?
目前對肝臟血管瘤還缺乏成熟而嚴格的診治標準,即使在醫學界,也存在著很多模糊甚至是錯誤的認識。這導致了多種治療方法同時存在。
肝臟血管瘤屬於良性腫瘤,手術切除(血管瘤切除術)是很有效的方式,也是根治的方法,患者手術切除後預後良好。對於瀰漫性的肝血管瘤,或者無法切除的巨大血管瘤,也可以考慮肝移植。對於其他的治療方式:如介入栓塞等,我們建議患者慎重使用。
哪些特殊人群需要單獨對待?
剛才說了,通常我們建議血管瘤比較大,或者出現症狀的患者治療。但每個人情況不同,需要單獨分析。對於有些特殊人群,選擇可能和大眾會不同。
比如,對於年齡大於60歲病人,因為血管瘤很可能不再生長或生長較慢,因此是否要需要手術,會更加謹慎。
反之,由於肝血管瘤生長和激素有關,可能在妊娠期增大加快,分娩時可致破裂大出血,因此對青年女性巨大的肝血管瘤,應積極手術切除。
另外,對於從事劇烈運動者,比如拳擊手、足球運動員等,由於擔心運動衝擊造成的腫瘤和血管破損,也可以考慮手術切除。等等。
總而言之,肝臟血管瘤屬於良性,並不可怕。如果您體檢發現自己有肝臟血管瘤,不用緊張,請到醫院肝膽專科就診。經增強影像確診為血管瘤後,如果血管瘤體積小且沒有症狀,只需定期復查超聲就好了,如果病灶較大或者有別的風險,那建議找有經驗的醫生,檢查後選擇合理的治療方式,多數也都能治愈。
*本文旨在科普癌症背後的科學,不是治療方案推薦。如需獲得疾病治療方案指導,請前往正規醫院就診。

根據美國疾病控制和預防中心(CDC)的數據,癌症是美國第二大死亡原因。然而,當涉及到癌症的信息時,公眾的知識仍然相對匱乏。更糟糕的是,如此多關於癌症的誤解在線上和線下廣泛傳播,使得人們很難區分真正的醫療建議和毫無根據的謬論。
為此,我們收集了科學證據和專家醫療建議,來揭穿一些常見的癌症誤區。
誤區1:吃糖會使癌症惡化
真相:也許是因為癌細胞比其他細胞消耗更多的葡萄糖,人們開始相信吃糖會使病情惡化的謬論。然而,美國國家癌症研究所反駁了這一說法,指出,“沒有研究表明吃糖會使你的癌症惡化,或者如果你停止吃糖,你的癌症會縮小或消失。”
誤區2:攝入的乳製品越多,得乳腺癌的可能性就越大
真相:不,你不需要為了遠離乳腺癌而放棄帕瑪森乳酪和酸奶凍糕。2002年發表在《國際流行病學雜誌》(International Journal ofEpidemiology)上的一項關鍵研究得出結論:“攝入乳製品中全部液體或全部固體乳製品,與乳腺癌風險之間沒有顯著關聯。 ”
誤區3:食用人造甜味劑會致癌
真相:在20世紀70年代和80年代,當研究表明人工甜味劑,如糖精和阿斯巴甜,可能在老鼠體內引起癌症時,人們開始擔心。但進一步的測試證明,這些物質對人類沒有同樣的影響。今天,美國食品和藥物管理局(FDA)堅持認為,所有這些代糖(除了甜蜜素)都可以安全食用。
誤區4:使用手機會導致癌症
真相:這個常見的癌症誤區源於手機會發出電磁輻射的事實。然而,高頻輻射(比如x射線)和低頻輻射(手機輻射)是有區別的。雖然高頻輻射會增加你患癌症的風險,但沒有確鑿的證據表明,低頻輻射對身體有這樣的影響。2015年,新興和新發現健康風險科學委員會的一項研究指出,“關於手機射頻電磁場暴露的流行病學研究沒有證明這一點。”
誤區5:癌症是100%會遺傳的
真相:儘管對癌症病因的研究仍在進行中,但美國國家癌症研究所認為,可遺傳的癌症數量在5%-10%之間。剩下的90%到95%的已知癌症是由各種因素造成的,從接觸有害的環境因素(如煙草)到由於衰老而導致的自然基因突變。
誤區6:只有女性才會得乳腺癌
真相:雖然不太常見,但男性也有可能患乳腺癌。根據非盈利網站Breastcancer.org的數據,男性一生中平均有1/883的機率患上乳腺癌。
誤區7:如果乳房X光檢查正常,那麼就沒得乳腺癌
真相:加州普羅維登斯聖約翰中心的乳腺外科腫瘤學家、醫學博士Janie Grumley說:“乳房X光檢查可能會漏掉一些重要的發現。”“如果有乳房症狀,光做乳房X光檢查是不夠的。”有乳腺癌遺傳易感性的患者尤其應該進行核磁共振成像檢查,以便進行更準確的篩查。
誤區8:染髮會增加患癌症的風險
真相:關於染髮劑致癌作用的研究結果相互矛盾。因此,國際癌症研究機構得出結論稱,染髮劑的使用“無法歸類為對人類的致癌性”——儘管他們確實警告稱,“美髮師或理髮師的職業暴露可能有致癌風險。”
誤區9:體重與患癌風險無關
真相:你的體重和患癌症的風險是直接相關的。根據2015年發表在《柳葉刀腫瘤學》(The Lancet Oncology)雜誌上的一項研究,2012年,在所有新增成人癌症病例中,估計有3.6%與體重有關。關於為什麼肥胖會使人們患癌症的風險增加,有很多可能的解釋。一是超重的人通常有慢性低水平炎症,隨著時間的推移會損害DNA並發展成疾病。
誤區10:深色皮膚的人不會得皮膚癌
真相:深色皮膚並不能保護你免受太陽的傷害。事實上,雖然皮膚癌在膚色較淺的人身上更常見,但2014年發表在《美國皮膚病學會》(the Journal of theAmerican Academy of Dermatology)雜誌上的一項研究發現,這種疾病在膚色較深的人身上更致命。更重要的是,有些皮膚癌——比如導致36歲的鮑勃·馬利(Bob Marley)死亡的肢端黑素瘤——在有色人種中更常見,所以出門前一定要塗防曬霜。
誤區11:使用止汗劑會導致乳腺癌
真相:這個誤區源於網上的一個謠言,說止汗劑中的物質可以滲透到腋窩的淋巴結,使細胞發生突變,從而導致癌症。然而,美國癌症協會反駁了這一說法,指出“幾乎沒有科學證據”來支持這一假定的科學。在比較了813名患有乳腺癌的女性和793名沒有患病的女性後,2002年發表在《美國國家癌症研究所雜誌》上的一項著名研究發現,患乳腺癌的風險與使用止汗劑、除臭劑或刮腋毛之間沒有聯繫。
誤區12:隆胸會增加患乳腺癌的風險
真相: 2001年發表在《整形與重建外科》雜誌上的一項重要的薈萃分析得出結論:“乳房植入物不會對乳腺癌構成任何額外風險。”因此,如果你想要隆胸,沒有理由害怕。然而,值得注意的是,在移植體和一種罕見的可治療癌症間似乎有一個非常小的聯繫,這種癌症被稱為間變性大細胞淋巴瘤。
誤區13:癌症治療必須住院
真相:雖然癌症的治療確實需要多次去醫院,但是並不需要一直待在醫院裡。事實上,許多早期癌症患者能夠繼續他們的生活,去醫院只是為了治療和檢查。
誤區14:只有吸煙的人才會得肺癌
真相:雖然吸煙的人患肺癌的可能性是不吸煙的人的30倍,但那些不吸煙的人也有患肺癌的風險。這要歸功於二手煙、空氣中的氡和接觸石棉等其他因素。
誤區15:如果你有HPV,那麼你肯定會得宮頸癌
真相:隨著時間的推移,一些人類乳頭瘤病毒(HPV)菌株會發展成宮頸癌,但並非總是如此。據美國性健康協會估計,美國每年約有1400萬新發HPV病例,但今年早些時候,美國臨床腫瘤學會腫瘤學家估算,被診斷出宮頸癌的女性相對要少得多,只有13170人。
誤區16:態度不好會讓你的癌症惡化
真相:通常情況下,當一個患有癌症的人沒有看到任何改善,他們的本能是責怪自己和他們的消極態度是問題的根源。然而,美國癌症協會指出,人格特徵和癌症存活率之間似乎沒有聯繫,“根據我們現在對癌症的起源和發展的了解,沒有理由相信情緒會導致癌症或幫助癌症的發展。”
誤區17:做手術會導致癌症擴散
真相:新南威爾士州癌症委員會表示:“沒有證據支持手術會導致癌症擴散的觀點。”因為疾病完全通過血液生長和繁殖,所以做手術是不會使病情惡化的。
誤區18:草藥補充劑可以治愈癌症
真相: 2013年發表在《循證補充和替代醫學》(Evidence-Based Complementary and Alternative Medicine)雜誌上的一項研究表明,草藥補充劑可以幫助癌症患者走上緩解之路,但只有在與傳統療法結合使用時才有效。此外,一些草藥補充劑與傳統藥物的相互作用很差,在開始新的實驗療法之前,讓醫生知道你想嘗試哪些草藥療法很重要。
誤區19:暴露在空氣中會導致癌症擴散
真相:因為許多人在做完活檢後,感覺比他們做活檢前更糟,所以他們認為,將癌症暴露在空氣中會使病情惡化。然而,正如作者Jamie Schwachter和Josette Snyder在他們的書籍《The Complete Cancer Organizer》中指出,“沒有事實證據表明病變的活檢可以導致癌症擴散,也沒有任何證據表明,將腫瘤暴露於空氣中會導致癌症腫瘤擴散到身體的其他部位。”
誤區20:化療都是有副作用、令人痛苦的
真相:自20世紀40年代和50年代首次使用化學療法以來,化療已經取得了長足的進步。美國癌症治療中心塔爾薩分部的醫學腫瘤學家Issam Alawin博士在該組織的網站上解釋說:“我們做了很多有益的事情來減少,甚至消除這些副作用。”
誤區21:癌症是會傳染的
真相:正如美國癌症協會所指出的,癌症本身是不會傳染的,你不能從其他癌症患者那裡感染疾病。然而,也有一些傳染性病毒可以引起癌症。如人乳頭狀瘤病毒、乙型肝炎和丙型肝炎具有傳染性,並可最終導致癌症。
誤區22:氟化物會致癌
真相:儘管陰謀論者對自來水供應持懷疑態度,但從牙膏到其他補給品中都能找到的氟化物並不會致癌。1991年2月,美國衛生與公眾服務部審查了50多項人類人口研究,並宣布這種天然物質“不會對人類構成可檢測到的癌症風險”。
誤區23:得了癌症就等於被判了死刑
真相:由於技術進步和醫學發現,一個人患癌症後生存的機率比過去高了很多。根據美國國家癌症研究所的數據,所有類型的癌症的5年存活率,整體約為67%,而乳腺癌、前列腺癌和甲狀腺癌等特定癌症的5年存活率已經高達90%。
事實上,有的癌症5年生存率還能更高。癌症,已經成為一種可以治癒的癌症,不應把它看做是“死亡的宣告”。
來源:
本文主要內容編譯自bestlifeonline網站2019年12月16日發布的《23 Myths About Cancer You've Always Believed》,原文鏈接:
https://bestlifeonline.com/cancer-myths/

最近基因圈也流行跨界。
前幾天,科學家發現強力致癌基因ALK 竟然還負責掌管人類的體重。
今天,洛克菲勒大學Sohail F. Tavazoie團隊,又有了讓人意外的發現[1]: 與阿爾茨海默病關係最強的APOE4基因可能會抑制黑色素瘤的轉移,大幅延長患者的生存時間 。
究其原因,竟然是 APOE4 可以提高免疫系統抵抗腫瘤的能力 。研究人員還發現, APOE4 不僅能讓免疫治療對患者的療效更好,而且還與黑色素瘤患者的生存時間顯著延長有關。
APOE的這種雙面功能,簡直讓人措手不及。
這真是“禍兮福所倚,福兮禍所伏”,或者“魚與熊掌不能兼得”。
▲ 瀟灑的Sohail F. Tavazoie
Tavazoie團隊的這項研究成果今天發表在頂級期刊《自然·醫學》上。Tavazoie認為,他的這項研究成果 首次證實,遺傳自父母的先天性基因型(非後天突變獲得)可以影響惡性腫瘤的進展和預後 。
就這個研究的意義而言,Tavazoie認為 或許APOE基因型可以作為預測黑色素瘤患者的預後和對免疫治療反應的標誌物 ,有必要圍繞這個結論展開前瞻性的臨床研究。
“患者經常會問'我為什麼這麼倒霉?為什麼我的癌症會擴散?'作為醫生,我們一直沒有答案。”Tavazoie說[2],“我們的這項研究提供了一個解釋。”
轉移是癌症導致患者死亡的最主要原因。
關於癌症的轉移,目前有一個重要的觀點是: 隨著癌症的發展,新的基因變異不斷出現,這才讓癌細胞具備了轉移能力 。遺憾的是,科學家雖然在尋找負責癌症轉移的基因突變這件事情上花了幾十年,但是依然沒有找到這樣的基因。
早在2012年之前,Tavazoie團隊在研究癌症轉移的驅動力時,發現 載脂蛋白E(APOE)似乎能抑制黑色素瘤的轉移 [3]。不過有個困擾他們的問題是,雖然黑色素瘤在發展的過程中會抑制APOE的表達,但是腫瘤外的正常細胞也可以表達APOE啊,為什麼黑色素瘤還是會轉移呢?
當他們想到APOE有3種變體的時候,就豁然開朗。
Tavazoie推測, 不同的APOE蛋白可能對腫瘤的進展有不同的調控作用 。
我相信大家對APOE蛋白肯定很熟悉了, 它除了與阿爾茨海默病有關之外,還與人體的代謝和免疫力有關 [4,5]。
APOE可分為三種亞型,APOE2、APOE3和APOE4,其中APOE4與阿爾茨海默病的關係最為密切,而APOE2可以降低攜帶者患阿爾茨海默病的風險,APOE3就是普通型。這三種亞型與受體的結合和激活均存在差異。…
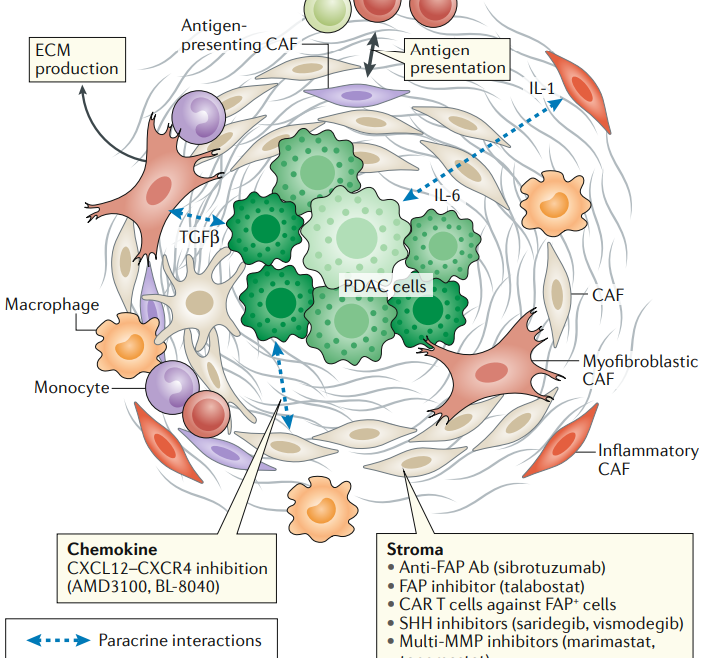
胰腺癌,也許是免疫治療最難啃的一塊硬骨頭。
厚重的細胞外基質作為防護殼,抑制性極強的免疫微環境,加上狡詐多端的癌細胞,此前所向披靡的PD-1抑製劑,也沒法上演單騎救主的好戲。
但是我們還有“協同作戰”這一招。近期公佈的 臨床 試驗 COMBAT(KEYNOTE-202)的數據顯示,新型CXCR4抑製劑BL-8040(Motixafortide),配合PD-1抑製劑和化療聯合使用,在胰腺癌的二線/三線治療中初步效果良好。
這種三聯療法,在試驗中作為二線治療使用,疾病控制率達到77%,其中35%的患者實現了客觀緩解,緩解持續時間達到7.8個月,這些數據都是胰腺癌治療多年來難得的進步 [1]。相關數據發表在《自然·醫學》上。
看到Review上的新藥出成績,不錯不錯
(圖片來源:Nature Reviews Clinical Oncology)
對於胰腺癌為什麼難治,科學家們已經總結出了不少原因,其中很重要的一條就是腫瘤微環境當中,CD8+T細胞的數量實在是太少。即使免疫檢查點抑製劑能穿越重重屏障抵達腫瘤部位,也很難調動起足夠強大的抗腫瘤免疫應答[2]。
所以要想讓PD-1抑製劑們具備挑戰胰腺癌的能力,就得給它配上可靠的隊友。本次試驗中使用的CXCR4抑製劑,就是近年來頗受關注的新星,因為很多癌細胞都存在CXCR4的高表達。
具體到胰腺癌的話,抑制CXCR4一方面可以增加腫瘤微環境中T細胞的數量,同時還可以針對一下胰腺癌細胞外基質中,大量存在的腫瘤相關成纖維細胞(CAF)[3-4]。這樣雙管齊下,就能削弱胰腺癌腫瘤微環境對於免疫治療的不利影響。
圖上的每一個要素,都可能對免疫治療效果有影響
(圖片來源:Nature Reviews Clinical Oncology)
動物實驗也顯示,PD-1/L1抑製劑與CXCR4抑製劑聯合使用,會存在協作增效性,所以讓這兩種藥物聯手,就是非常自然的選擇了。
接下來就說說COMBAT試驗,這項試驗分為兩部分進行,第一部分先是驗證BL-8040+帕博利珠單抗,作為後線治療的安全性和初步療效。在胰腺癌當中,三線和三線以上的治療難度很大,缺乏成熟的方案。
這部分試驗總共有29名患者參與,BL-8040+帕博利珠單抗的整體疾病控制率為34.5%,只有一名患者達到客觀緩解,這也體現了胰腺癌的“硬骨頭”。
但分析數據顯示, 療效主要體現在二線治療的16名患者當中,他們的中位生存期達到7.5個月,明顯優於此前FDA批准的伊立替康脂質體+氟尿嘧啶+亞葉酸鈣方案的生存期(6.1個月) 。
三線及三線以上的患者,把左邊的患者整體生存期拉得好低……
各種檢測結果也提示,BL-8040+帕博利珠單抗的治療,增加了外周血中活化T細胞的水平,減少了調節性T細胞的數量,浸潤到腫瘤內的CD8+T細胞也明顯增多。
活化T細胞是側面衡量療效的手段
基於這些結果,研究團隊在試驗第2部分專門入組了22名吉西他濱一線治療後,病情出現進展的轉移性胰腺癌患者,在BL-8040+帕博利珠單抗的基礎上,加用伊立替康脂質體+氟尿嘧啶+亞葉酸鈣的三藥化療方案進行治療。
有了化療強力增援,療效立馬就上去了。 22名患者中有7名實現部分緩解,客觀緩解率為32%,而中位緩解持續時間達到了7.8個月,明顯優於單純化療。再算上10名治療後病情未進展的患者,整體的疾病控制率(DCR),達到了77% !
緩解和疾病控制,持續時間都不差嘛
三藥化療方案在此前的臨床III期試驗中,客觀緩解率和疾病控制率分別是17%和52%[5]。而且這22名患者中並不存在微衛星不穩定性高(MSI-H),更適合免疫治療的患者,所以BL-8040+帕博利珠單抗提升的療效就更不易了。
雖然看似用藥很多,但22名患者中只有兩名因為副作用明顯而停藥,3-4級的嚴重不良事件以腹瀉和乏力為主,發生率也比較低。 因此研究團隊認為,治療方案也是安全可耐受的 。
不過在本次論文中,並沒有公佈試驗第2部分的總生存期(OS)、無進展生存期(PFS)等指標。BL-8040和PD-1抑製劑的搭檔到底能體現多大價值,就有待後續數據和試驗去揭曉啦。
編輯神叨叨
1.Bockorny…
